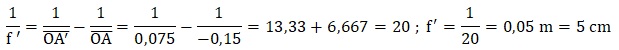Physique
chimie, les comprimés de permanganate de potassium sont-ils périmés ?
Protection solaire.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Les
comprimés de permanganate de potassium son-ils périmés ?
Un tube de comprimés porte l'indication 0,25 g de
permanganate de potassium.
1. Conception d’un
colorimètre.
Ne disposant pas de spectrophotomètre, la technicienne réalise le
montage correspondant au schéma ci-suivant pour construire un
colorimètre.
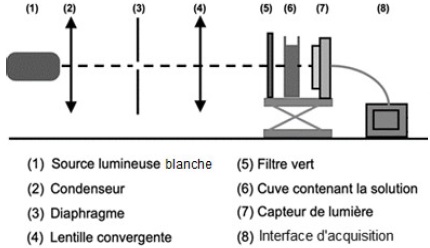
La lentille (4) permet de fabriquer un faisceau de lumière parallèle ;
le constructeur indique, pour cette lentille, une valeur de
distance focale de 5,0 cm.
1.1. La
technicienne souhaite vérifier la valeur de la distance focale de cette
lentille. Elle place la lentille à 15,0 cm d’un objet lumineux AB.
L’image A’B’ se forme alors sur un écran qu’elle doit placer à 7,5 cm
de la lentille.
1.1.1. Montrer que
les mesures faites par la technicienne sont cohérentes avec la valeur
indiquée par le constructeur.
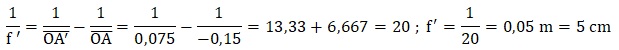
1.1.2. Quelle autre
expérience rapide aurait-elle pu mettre en oeuvre pour estimer la
distance focale de la lentille ?
Observer sur un écran l'image d'un objet à l'infini. La distance
lentille-écran est égale à la distance focale.
1.2. Justifier le
choix de placer le filtre vert (5) devant la cuve contenant la solution
pour réaliser les mesures.
La solution de permanganate de potassium de couleur violette présente
un maximum d'absorption vers 530 nm. 530 nm, couleur verte
complémentaire du violet. Pour une meilleure précision, on choisit la
longueur d'onde correspondant au maximum d'absorption de la solution.
1.3. Le capteur de
lumière (7) est constitué du montage suivant.
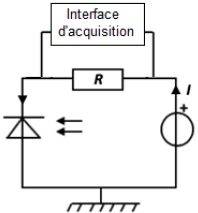
Il comporte une photodiode. La photodiode laisse circuler dans le
circuit un courant électrique d’intensité I proportionnelle à
l'éclairement qu’elle reçoit. On connecte l’interface d’acquisition aux
bornes de la résistance R.
Justifier que, dans ce montage, la tension électrique U mesurée par la
centrale d’acquisition aux bornes de la résistance R, est
proportionnelle à l’éclairement reçu par la photodiode.
La tension aux bornes d'un résistor est proportionnelle à l'intensité
du courant qui la traverse : U = RI.
L'intensité du courant est proportionnelle à l'éclairement reçu par la
photodiode.
La tension
électrique U aux bornes de la
résistance R, est proportionnelle à l’éclairement reçu par la
photodiode.
2. Dosage
du permanganate de potassium dans un comprimé
2.1. Méthode de
dosage utilisée.
Pour vérifier la conformité des comprimés, la technicienne prépare une
gamme étalon à partir d'une solution de permanganate de
potassium de concentration connue. Elle utilise ensuite le colorimètre
qu’elle a construit.
Un traitement des données expérimentales acquises par l’interface
d’acquisition, permet à la technicienne d’obtenir la valeur de
l’absorbance A de chaque solution étalon. Elle trace le graphe
représentant l’évolution de l’absorbance A en fonction de la
concentration C de la solution en permanganate de potassium. Indiquer
si avec la gamme étalon utilisée, la relation de Beer-Lambert peut
s’appliquer.
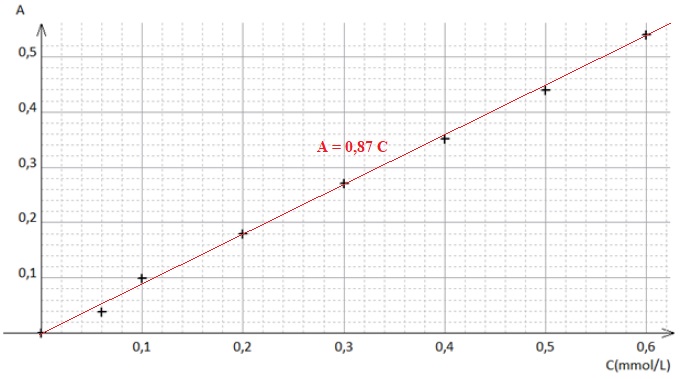 L'absorbance et la
concentration sont proportionnelles. La relation de
Beer-Lambert peut s'appliquer.
2.2. Détermination de la masse de
permanganate de potassium dans un comprimé.
L'absorbance et la
concentration sont proportionnelles. La relation de
Beer-Lambert peut s'appliquer.
2.2. Détermination de la masse de
permanganate de potassium dans un comprimé.
Pour déterminer la composition en permanganate de potassium d’un
comprimé, la technicienne met en oeuvre les étapes suivantes :
Étape 1 : elle prépare une solution aqueuse S0 de volume V0
= 0,500 L dans laquelle est dissoute un comprimé.
Étape 2 : elle dilue 10 fois la solution S0 pour obtenir
une solution S1
Étape 3 : elle mesure la tension aux bornes de la résistance pour la
solution S1 et obtient, après traitement de la mesure, une
absorbance A = 0,28.
2.2.1. Identifier
le matériel nécessaire à une réalisation précise de la dilution
présentée dans l'étape 2 et rédiger le protocole.
Verser environ 20 mL de la solution mère dans un becher de 50 mL.
Prélever 10,0 mL de la solution mère à l'aide d'une pipette jaugée de
10,0 mL.
Verser dans une fiole jaugée de 100,0 mL.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et
agiter pour rendre homogène.
2.2.2. Exploiter le
graphique pour déterminer la valeur de la concentration en quantité de
matière C1 en permanganate de potassium dans la solution
diluée S1.
C1 = A / 0,87 = 0,28 / 0,87 = 0,32 mmol / L.
2.2.3. Le comprimé
a-t-il conservé sa composition d'origine ?
Compte tenu de la dilution au dixième, un comprimé contient 3,2 x 0,5 =
1,6 mmol de permanganate de potassium.
M(KMnO4) =158 g / mol.
Masse de KMnO4 dans le comprimé : 158 x 1,6 ~2,5 102
mg ( 0,25 g).
La composition d'origine est conservée.
3. Rédaction d’un compte
rendu de l’expérience.
La technicienne utilise, sur son ordinateur, un logiciel de traitement
d'images pour schématiser l'expérience en couleur.
3.1. Un écran
d’ordinateur est constitué de pixels eux-mêmes divisés en trois
sous-pixels
- Rouge (R), Vert (V) et Bleu (B) - émettant chacun une lumière
d’intensité réglable entre 0 et 100%.
- Un sous pixel réglé à 100% est totalement éclairé. - Un sous pixel
réglé à 0% est totalement éteint.
Identifier, parmi les propositions suivantes, celle qui permet de
reproduire sur l'écran la teinte de la solution de permanganate de
potassium. Justifier ce choix.
La solution de permanganate de potassium est de couleur magenta,
mélange de rouge et de bleu.
Proposition 3 : R : 88,6 % ; B : 95,3 % ; V : 10,8 %.
3.2. Préciser le
type de synthèse des couleurs (additive ou soustractive) mise en jeu.
3.2.1. Lorsque « le
cerveau fait la synthèse des lumières reçues par l'oeil » face à un
écran. Synthèse additive.
3.2.2. Lors de
l’impression du document sur une imprimante à jet d'encre. Synthèse
soustractive.
|
|
Protection solaire.
L'acide para-aminobenzoïque ou acide 4-aminobenzoïque, représenté ci-dessous, a des propriétés de photoprotecteur. Il est
nommé PABA (pour « para-aminobenzoic acid »).
Le rayonnement solaire qui atteint la Terre est composé de rayonnements
infrarouges, de lumière visible et de rayonnements ultraviolets
potentiellement nocifs. Les crèmes de protection solaire qui
contiennent des substances actives appelées filtres organiques agissent
par absorption d’une partie des rayonnements ultraviolets. Le PABA est
le plus ancien filtre organique. Utilisé dès le début des années 70
dans les crèmes solaires, il est résistant à l’eau et la transpiration.
Cependant, en raison de son instabilité au soleil et de son potentiel
allergisant, il a été peu à peu abandonné.
Dans cet exercice seront étudiés le rôle de PABA comme photoprotecteur
et comme réactif pour produire une autre substance active utile pour
soulager des « coups de soleil ».
1. Protéger sa peau.
L’acide para-aminobenzoïque est préconisé dans la prévention et le
traitement de certaines maladies de la peau dues au soleil ; il est
alors utilisé par voie interne, sous forme de comprimés à avaler, avant
une exposition solaire, mais peut aussi être utilisé par voie externe
dans une crème, pendant l’exposition. On donne ci-dessous l’allure du
spectre UV-visible du PABA en solution dans l’éthanol.
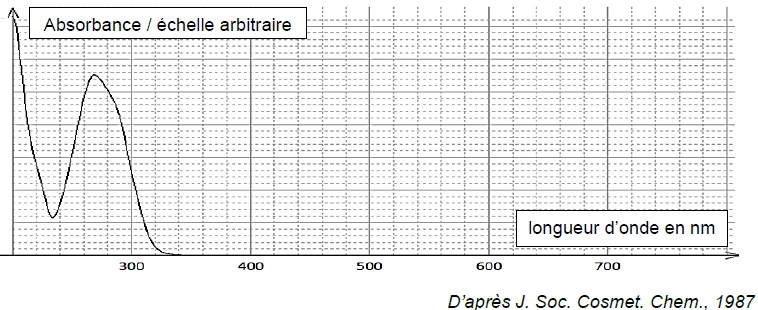
1.1. Estimer la quantité de matière de PABA contenue dans un comprimé enrobé comportant 1000 mg de substance active.
P(PABA) = 157 g / mol ; 1000 mg = 1,00 g ; 1,00 / 157 ~ 6,4 10-3 mol.
1.2. Indiquer si une solution de PABA dans l’éthanol est colorée. Justifier.
1.3. Justifier que le PABA est un filtre organique solaire.
La solution présente un maximum d'absorption vers 260 nm ( domaine UV). Elle est incolore.
Le PABA absorbe une grande partie des UV-B ( 280 : 315 nm) ; c'est un filtre solaire.
2. Soulager sa peau.
Le « coup de soleil » est une brûlure, généralement du premier degré,
causée par une exposition prolongée au rayonnement solaire de la peau
non protégée ; il peut être très douloureux. La benzocaïne est un
anesthésique local pouvant être utilisé dans les médicaments soulageant
les brûlures mineures. Sa synthèse au laboratoire peut s’effectuer à
partir du PABA et elle est modélisée par la réaction d’équation
suivante :
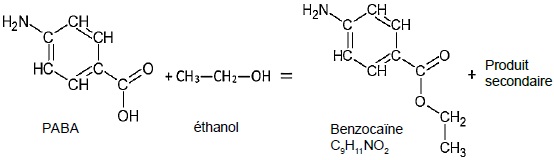
Le protocole expérimental mis en oeuvre est le suivant.
Dans un ballon de 100 mL introduire une masse mPABA = 1,50 g
(10,9 mmol) de PABA et un volume V = 20 mL d'éthanol pur. Agiter
jusqu'à dissolution du solide et ajouter, avec précaution, environ 2 mL
d'acide sulfurique concentré. Adapter au ballon un réfrigérant à eau et
porter le
mélange au reflux pendant une heure. À la fin du chauffage, laisser
revenir le mélange réactionnel à température ambiante […] D’après
Bac2006, Bac2015 et Iftlm.fr
2.1. Réaction modélisant la synthèse de la benzocaïne

2.1.1. Justifier le nom éthanol associé au deuxième réactif.
Deux atomes de carbone : chaîne carbonée de l'éthane.
Une fonction alcool : on remplace le "e" terminal du mot éthane par "ol".
2.1.2. Ecrire
l'équation de la synthèse de la benzocaïne en utilisant les formules
brutes et en déduire quel est le produit secondaire accompagnant sa
formation.
C7H7O2N +C2H6O = C9H11O2N + H2O.
2.1.3. Reproduire et compléter le tableau d’avancement suivant puis montrer que PABA est le réactif limitant.
2.1.4. Déterminer la composition finale du système dans l’hypothèse d’une transformation totale.
|
avancement (mol)
|
C7H7O2N |
+C2H6O |
= C9H11O2N |
+ H2O |
initial
|
0
|
1,09 10-2
|
20 x0,79 / 46
=0,343
|
0
|
0
|
intermédiaire
|
x
|
1,09 10-2-x
|
0,343-x
|
x
|
x
|
fin
|
xf = 1,09 10-2
|
0
|
0,332
|
1,09 10-2 |
1,09 10-2 |
|
2.2. Protocole et résultats.
2.2.1. Schématiser et légender le schéma expérimental du montage à reflux.
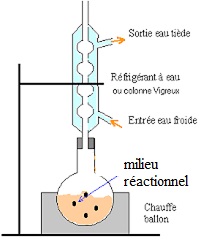
Le dispositif peut être placé sur un élévateur à croisillons.
À
la fin des étapes de transformation et isolement, un solide blanc
qualifié de « produit brut » est obtenu. Ce solide est ensuite purifié
par recristallisation, et la poudre cristallisée blanche
obtenue est séchée et pesée. On obtient une masse de produit sec
purifié de 0,81 g. Une chromatographie sur couche mince est effectuée
et le chromatogramme obtenu après
révélation est reproduit ci-après.
Les échantillons à étudier sont d’abord dissous dans l’éthanol. Ils
sont déposés sur la ligne de dépôt de la plaque recouverte de gel de
silice.
La plaque est placée dans une cuve de chromatographie contenant
l’éluant éthanoate d’éthyle. La plaque est séchée puis révélée sous UV.
2.2.2. Justifier que la recristallisation a été efficace.
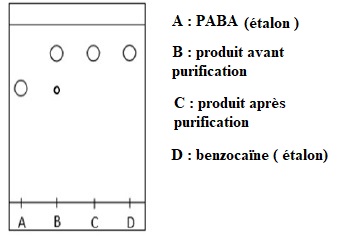
Avant purification, le produit contient des traces de PABA. Après
putification, le produit ne contient que de la benzocaïne. La
recristallisation a été efficace.
2.2.3. Déterminer la valeur du rendement de la synthèse. Commenter et proposer plusieurs hypothèses pouvant expliquer cette valeur.
Masse expérimentale de benzocaïne : 0,81 g : M(benzocaïne )= 165 g /mol ; nexpérimental = 0,81 / 165 = 4,9 10-3 mol = 4,9 mmol.
A partir de 10,9 mmol de PABA, on peut théotiquement obtenir 10,9 mol de benzocaïne.
Rendement : 4,9 / 10,9 ~0,45 (45 %).
La réaction d'estérification n'est pas totale, mais limitée par l'hydrolyse de l'ester.
|
|
|