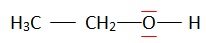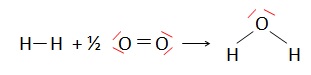Physique
chimie, détermination du degré alcoolique d'un vin d'épines ;
dihydrogène et ballons dirigeables,
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Détermination
du degré alcoolique d'un vin d'épines.
L’objectif de cet exercice est d’étudier quelques propriétés de
l’éthanol et de déterminer le degré d’alcool d’un vin d’épines.
1. À propos de l’éthanol.
1.1. Représenter le
schéma de Lewis de l’éthanol.
1.2. Justifier le
fait que la molécule d’éthanol est une molécule polaire.
1.3. Expliquer
pourquoi l’éthanol est miscible avec l’eau.
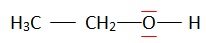
L'atome d'oxygène porte deux doublets non
liants.
L'atome d'oxygène est
plus électronégatif que les atomes de carbone et d'hydrogène. La
molécule d'éthanol est polaire.
L'eau est également un solvant polaire. L'éthanol et l'eau sont
miscibles.
1.4. En présence
d’un excès d’oxydant, l’éthanol peut être oxydé en acide éthanoïque.
Les spectres infrarouges de l’acide éthanoïque et de l’éthanol sont
donnés ci-dessous.
Expliquer comment on peut les utiliser pour justifier que la
transformation de l’éthanol en acide éthanoïque a eu lieu.
Le spectre IR de l'éthanol ne présente pas de pic étroit et intense
vers 1700 cm-1.
Le spectre IR de l'acide éthanoïque présente une bande intense et
étroite vers 1700 cm-1, due à la liaison C=O du groupe
carboxyle.
2. Détermination du degré
d’alcool du vin d’épines.
Le vin d’épines étant constitué de diverses espèces chimiques, on
effectue une distillation fractionnée d’un mélange de 50 mL de vin
d’épines et d’eau pour en extraire l’éthanol. On verse le distillat
dans une fiole jaugée de 500 mL et on complète avec de l’eau distillée.
On obtient 500 mL de solution notée S contenant tout l’éthanol
initialement présent dans 50 mL de vin d’épines.
L’éthanol réagit avec les ions permanganate en milieu acide, mais cette
transformation, quoique totale, est lente : elle ne peut donc pas être
le support d’un titrage. On procède donc en deux étapes.
Étape 1 : on introduit les ions permanganate en excès dans un volume
donné de la solution S pour transformer tout l’éthanol présent en acide
éthanoïque et on laisse le temps nécessaire à la transformation de
s’effectuer.
Étape 2 : on réalise ensuite le titrage des ions permanganate restants
par les ions Fe2+.
2.1. Étude de l’étape 1.
On s’intéresse ici à la réaction entre les ions permanganate et
l’éthanol.
Dans un erlenmeyer, on mélange V0 = 2,0 mL de solution S et V1
= 25,0 mL d'une solution acidifiée de permanganate de potassium (K+(aq)
+MnO4-(aq)) de concentration en quantité de
matière C1 = 5,00.10–2 mol.L–1 .
On bouche l'erlenmeyer et on laisse réagir pendant environ 30 minutes,
à 60°C.
2.1.1. Établir que
l’équation de réaction entre l’éthanol et les ions permanganate en
milieu acide s’écrit :
5 C2H6O(aq) + 4MnO4-(aq)+ 12 H+ (aq) → 5 C2H4O2(aq)
+ 4 Mn2+ (aq) + 11 H2O (l).
L'oxydant MnO4-(aq)
est réduit en Mn2+ (aq)
:4 { MnO4-(aq)
+8H+aq + 5e- ---> Mn2+aq + 4H2O.
}
L'éthanol réducteur s'oxyde en acide éthanoïque : 5 {C2H6O(aq) +H2O
---> C2H4O2(aq)+4H+aq
+ 4e- .}
4MnO4-(aq)
+32H+aq + 20e- +5C2H6O(aq) +5H2O--->
4Mn2+aq + 16H2O+5C2H4O2(aq)+20H+aq
+ 20e- .
Simplifier : 5
C2H6O(aq) + 4MnO4-(aq)+ 12 H+ (aq) → 5 C2H4O2(aq)
+ 4 Mn2+ (aq) + 11 H2O (l).
2.1.2.
Compléter le tableau d'avancement en utilisant comme notation : n0,
quantité de matière initiale d'éthanol présente dans le volume V0
et n1, quantité de matière initiale d'ions
permanganate présente dans le volume V1.
|
avancement
(mol)
|
5 C2H6O(aq) |
+ 4MnO4-(aq) |
+ 12 H+ (aq) |
--->
4Mn2+aq |
5 C2H4O2(aq) |
+ 11 H2O (l) |
initial
|
0
|
n0
|
n1
|
excès
|
0
|
0
|
solvant
|
en
cours
|
x
|
n0-5x
|
n1-4x
|
4x
|
5x
|
fin
|
xf
= n0 / 5
|
0
|
n1-4n0
/5
|
4n0/5
|
n0
|
2.2.
Étude de l’étape 2.
On titre les ions permanganate restants à la fin de l’étape 1,
directement dans l’erlenmeyer, par une solution aqueuse contenant des
ions Fe2+ à la concentration en quantité de matière C2
= 3,00.10-1 mol.L-1.
L'équation de la réaction de support du titrage entre les ions
permanganate MnO4- et les ions Fe2+
est :
MnO4-(aq)+ 5Fe2+aq
+8H+aq ---> Mn2+aq
+ Fe3+aq +4H2O (l).
Le volume de solution
titrante versé pour atteindre l’équivalence est V2éq = 14,1
mL.
2.2.1. Définir du
terme « équivalence » utilisé lors d’un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'ion permanganate
est en excès, après l'équivalence l'ion fer (II) est en excès.
2.2.2. Préciser, en
justifiant, le changement de couleur qui permet de repérer
l’équivalence.
L'ion permanganate est la seule espèce colorée.
Avant l'équivalence, il se trouve en excès ( teinte violette) ; après
l'équivalence, il est en défaut ( solution incolore).
2.2.3. Indiquer la
relation qui existe, à l’équivalence, entre les quantités de matière
d’ions permanganate présents initialement et les ions Fe2+
versés à l’équivalence.
n(Fe2+) = 5 n(MnO4-).
c2V2éq = 5 (n1-4n0 /5) =5n1-4n0
; n0 =5n1
/ 4 -c2V2éq /4 = =5c1V1
/ 4 -c2V2éq /4 dans 2,0 mL
de S0.
2.2.4. La quantité
d'éthanol initialement présente dans le volume 50 mL de vin d’épines
est alors donnée par la relation : néthanol=250×(5 / 4 c1V1-0,25
c2V2éq).
Déterminer si le degré d’alcool annoncé de ce vin d’épines est conforme
à celui annoncé pour ces apéritifs.
néthanol =250(1,25 x5,00 10-2 x 0,025 -0,25
x0,300 x0,0141)=250(1,5625 10-3-1,0575 10-3)=0,126
mol dans 50 mL de vin.
Le degré d’alcool d’une boisson alcoolisée, noté (°), correspond au
volume d'éthanol pur contenu dans 100 mL de boisson.
Masse d'éthanol pur : 0,126 x M(éthanol) = 0,126 x 46=5,8 g.
Volume correspondant = masse (g) / masse volumique éthanol ( g / mL)
=5,8 / 0,79 =7,3 mL dans 50 mL de vin.
Degré de ce vin : 7,3 x2 = 14,6 °.
Le vin d’épines est un apéritif alcoolisé qui titre environ à
environ 15 % en degré d’alcool.
Le degré d’alcool annoncé de ce vin
d’épines est conforme à celui annoncé pour ces apéritifs.
|
|
Dihydrogène et ballons dirigeables.
Cet
exercice a pour objectif, l’étude d’une transformation chimique
permettant de produire du dihydrogène, puis l’interprétation de
l’accident survenu en 1937 à l’Hindenburg, un ballon dirigeable gonflé
au dihydrogène.
1. Étude d’une transformation chimique permettant de produire du dihydrogène.
On introduit dans un erlenmeyer un morceau de ruban de magnésium Mg(s), de masse m= 40 mg, et un volume Va = 100 mL d’acide
chlorhydrique (H+(aq) + Cl–(aq)), solution aqueuse Sa de concentration en ions H+(aq) égale à Ca =5,0x10-1 mol.L-1.
En réalisant l’expérience à 20 °C, on recueille, par déplacement d’eau,
un gaz que l’on peut identifier à du dihydrogène dont on relève à
intervalle de temps réguliers le volume dégagé etl’on obtient le
graphique représenté ci-après.
L’équation de la réaction modélisant la transformation chimique s’écrit :
Mg(s) + 2 H+(aq) → Mg2+(aq) + H2(g).
1.1 Quelle(s) précaution(s) faut-il prendre pour manipuler de l’acide chlorhydrique ?
Cet acide étant corrosif, port de gants, blouse et lunettes.
1.2 Proposer un test pour montrer que le gaz formé au cours de cette transformation chimique est bien du dihydrogène.
Détonation en présence d'une flamme.
1.3 Identifier parmi les réactifs, celui qui joue le rôle d’oxydant et celui qui joue le rôle de le réducteur.
Oxydation du magnésium réducteur : Mg(s) --> Mg2+aq +2e-.
Réduction de H+aq, l'oxydant : 2 H+aq +2e- --> H2(g).
1.4 Déterminer les quantités de matière initiales des réactifs.
n(Mg) = 0,040 / M(Mg) = 0,040 / 24,3 =1,65 10-3 mol.
n(H+) = Ca Va = 0,50 x0,100 = 0,050 mol.
1.5 Compléter le tableau d’avancement et identifier le réactif limitant de cette transformation chimique.
|
avancement (mol
|
Mg(s)
|
+ 2 H+(aq) |
-->Mg2+(aq) |
+ H2(g) |
initial
|
0
|
1,65 10-3
|
0,050
|
0
|
0
|
en cours
|
x
|
1,65 10-3 -x
|
0,050-2x
|
x
|
x
|
fin
|
xf=1,65 10-3
|
0
|
0,050-2x1,65 10-3
=4,67 10-2
|
1,65 10-3 |
1,65 10-3 |
Si Mg(s), réactif limitant : 1,65 10-3 -xf = 0, xf = 1,65 10-3 mol.
S l'acide est le réactif limitant : 0,05 -2xf = 0; xf =0,025 mol.
On retient la plus petite valeur.
1.6 Montrer qu’en fin de transformation une quantité nH 2 = 1,6.10-3 mol de dihydrogène pourrait être formé si la transformation est totale.
1.7 A partir des mesures expérimentales effectuées :
- déterminer quand la transformation peut être considérée comme terminée ;
- relever la valeur du volume Vexp H2 de dihydrogène obtenu à la fin de l’expérience.
1.8 Peut-on considérer que la transformation étudiée est une transformation totale ? Justifier.
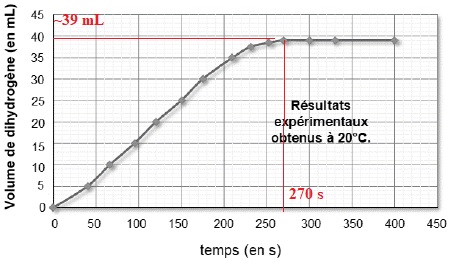
La transformation est terminée lorsque tout le magnésium est consommé :
le volume de dihydrogène est alors constant ( à t ~270 s), voisin de 39
mL d'après le graphique.
D'après le tableau d'avancement, il se forme 1,65 10-3 mol de dihydrogène.
Volume molaire des gaz dans ces conditions : 24 L / mol.
Volume de dihydrogène :1,65 10-3 x24 = 3,96 10-2 L = 39,6 mL, en accord avec le relevé expérimental.
La transformation étudiée est totale.
|
Un accident de dirigeable gonflé à l'hydrogène.
L’Hindenburg
a été le 129 ème dirigeable construit par la société allemande Zeppelin
entre 1935 et 1936. Dirigeable le plus grand et le plus luxueux jamais
construit, avec ses dimensions hors normes de plus de 240 m de long, il
pouvait accueillir 124 personnes et comportait une salle à manger, un
salon de lecture, un fumoir, des cuisines et plusieurs cabines.
Disposant d’un volume de dihydrogène de près de 200 000 m3 et de 4 moteurs il affichait une vitesse de croisière de plus de 120 km.h-1.
Le 6 mai 1937, lors de son 63ème voyage et après 77 heures de vol, il
s’est écrasé à l’atterrissage à Lakehurst dans le New Jersey.
On explique aujourd’hui cet accident de la façon suivante : après trois
jours de vol, le dirigeable chargé d’électricité statique et après
avoir rencontré un orage aurait connu une défaillance technique
engendrant une fuite de dihydrogène. Une décharge d’électricité
statique créée lorsqu’une des amarres du dirigeable a touché le sol
aurait amorcé la combustion du dihydrogène, réaction du dihydrogène
avec le dioxygène de l’air.
2.1.Établir les schémas de Lewis des molécules H2, O2 et H2O.
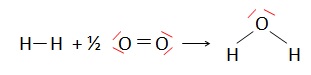
2.2.Identifier la nature et le nombre de liaisons rompues et formées au cours de la combustion du dihydrogène.
Liaisons rompues : une liaison H-H et la double liaison O=O.
Liaisons créées : 2 liaisons O-H.
Energie libérée par cette réaction : E = 0,5DO=O +DH-H -2 DH-O =0,5 x496 +436 -2 x463 = -242 kJ / mol.
2.3.Combien de
tonnes de TNT produiraient une énergie équivalente lors de son
explosion à celle produite par l’explosion du dihydrogène contenu dans
l’Hindenburg ?
Le TNT (trinitrotoluène) est un explosif. On compare souvent les
énergies produites lors des explosions en équivalent TNT, l’explosion
d’un gramme de TNT libérant une énergie de 4184 J.
Quantité de matière contenu dans le ballon : 200 000 / Vm = 200 000 / 0,024 =8,33 106 mol.
Energie libérée : 8,33 106 x 242 ~2,01 109 kJ.
Masse de TNT correspondante : 2,01 109 / 4,184 = 4,82 108 g = 4,82 105 kg = 4,82 102 t.
|
|
|