Le
vin et ses composants, bac Asie Pacifique 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
A.
Dosage spectrophotométrique des ions fer dans un vin.
Un vin blanc contient du fer sous forme d'ion fer (II) Fe2+aq, et fer III, Fe3+aq.
Si la teneur en fer dépasse 10 mg / L, on peut craindre la formation
d'un précipité blanc ( casse blanche pour le vin blanc).
On procède à un titrage spectrophotométrique des ions fer après avoir
oxydé les ions fer (II), puis on les fait réagir avec des ions
thiocyanate pour former une espèce colorée en solution.
Fe3+aq + SCN-aq --> (Fe (SCN)]2+ aq. ( couleur rouge).
On donne le spectre d'absorption de ces ions en phase aqeuse.
1. Justifier la couleur rouge de ces ions..
 Le maximum d'absorption
se situe vers 490 nm ( cyan). La solution possède la couleur
complémentaire du cyan, c'est à dire le rouge.
2. Proposer une longueur d'onde à utiliser pour le titrage.
Le maximum d'absorption
se situe vers 490 nm ( cyan). La solution possède la couleur
complémentaire du cyan, c'est à dire le rouge.
2. Proposer une longueur d'onde à utiliser pour le titrage.
Pour une bonne précision on se place au maximum d'absorption ( 490 nm).
Protocole de préparation des solutions étalons.
numéro de la solution
|
1
|
2
|
3
|
4
|
5
|
titre massique en ion fer III ( mg / L)
|
1,0
|
2,0
|
3,0
|
4,0
|
5,0
|
Verser 10 mL de chaque solution dans un becher.
Ajouter 1,0 mL d'acide chlorhydrique concentré et 1,0 mL de solution de
thiocyanate de potassium de concentration1,0 mol / L. ( ion en excès)
3. Pourquoi les ions thiocyanate doivent-ils être en excès.
On est ainsi certain que tous les ions fer(II) ont réagi.
4. Déterminer le volume de solution mère ( titre massique 100 mg / L) à prélever pour préparer V = 50,0 mL de la solution n°2.
Facteur de dilution ; F = 100 / 2 = 50.
Volume à prélever : 50,0 / 50 = 1,0 mL.
Mesure et analyse.
On prépare une solution de vin notée Sv en mélangeant :
10,0 mL de vin blanc.
1,0 mL d'acide chlorhydrique concentré et 1,0 mL de solution de thiocyanate de potassium à 1,0 mol / L
4 gouutes d'eau oxygénée à 20 volumes..
On mesure l'absorbance de toutes les solutions.
5. Préciser la relation entre A et t. Donner le nom de cette loi.
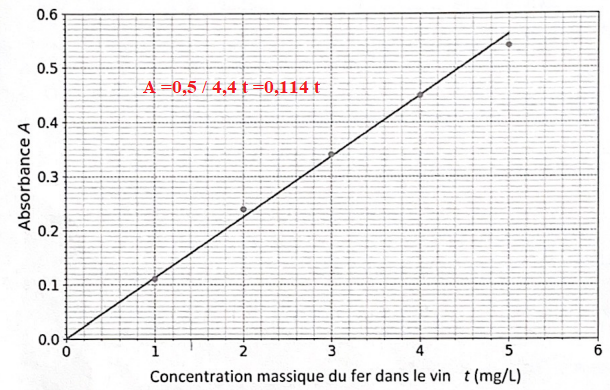
Loi de Beer-Lambert, absorbance et titre (ou concentration) sont proportionnelles.
6. Le vin présente t-il un risque de casse blanche ?
On a trouvé Av = 0,16.
t = A / 0,114 = 0,16 / 0,114 =1,4 mg / L.
Cette valeur étant inférieure à 10 mg / L, il n'y a pas de risque de casse blanche.
|
...
|
....
|
B. Synthèse d'un ester du vin..
Equation de la réaction de synthèse de l'éthanoate d'éthyle.
CH3COOH + CH3CH2OH = CH3 COO CH2CH3 + H2O (1).
Protocole :
Mélanger 115 mL d'acide éthanoïque et 117 mL d'éthanol. Placer au bain eau- glace.
Introduire 2,0 mL de ce mélange dans 7 tubes numérotés de 0 à 6. Mettre dans le bain eau glace.
Préparer une burette graduée contenant une solution d'hydroxyde de potassium à CB = 1,0 mol / L.
A t = 0 immerger les tubes 1 à 5 dans un bain marie d'eau bouillante et le tube 0 à température ambiante.
Aux dates t1 =2 min, t2 =7 min, t3 =12 min, t4 =20 min, t5 =35 min et t6 =50 min :
Retirer le tube "i" correspondant à la date ti et le plonger immédiatemment dans le bain eau glace.
Titrer l'acide éthanoïque de ce tube.
7. Pourquoi place t-on le tube "i" dans le bain eau glace juste avant le titrage ?
On réalise un blocage cinétique de la réaction d'estérification.
8. Montrer que le mélange réactionnel est équimolaire.
Acide éthanoïque : M = 60,0 g / mol ; densité 1,05.
Masse 115 x 1,05 =120,75 g ; n = 120,75 / 60,0 =2,01 mol.
Ethanol : M = 46,0 g / mol ; d = 0,789
Masse =117 x 0,789 =92,31 g ; n = 92,31 / 46,0 =2,00 mol.
.
9. Vérifier que la quantité d'acide contenu dans chaque tube à la date t=0 est n0 = 17,3 mmol.
Dans 232 mL de mélange il y a 2,01 mmol d'acide.
Dans 2,0 mL il y a 2,01 x 2 / 232 =0,0173 mol = 17,3 mmol d'acide.
Equation support du titrage.
CH3COOH aq + HO- aq --> CH3COO-aq + H2O(l).
10. Quel est le rôle du bleu de thymol ?
Indicateur coloré de fin de réaction.
11. Définir l'équivalence pour la réaction support du titrage.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques.
12. En déduire que
la quantité d'acide restant n ac, i à la date ti dans le tube "i" est nac, i = CB VB i.
VB i : volume de soude versé à l'équivalence.
A l'équivalence : nac i = quantité de matière de soude versée à l'équivalence = CB VB i.
13. Etablir le tableau d'avancement de la transformation chimique modélisée par la réaction (1).
|
avancement (mmol)
|
CH3COOH |
+ CH3CH2OH |
= CH3 COO CH2CH3 |
+ H2O |
initial
|
0
|
n0=17,3
|
n0=17,3
|
0
|
solvant
|
intermédiaire
|
x
|
n0-x
|
n0-x
|
x
|
à l'équilibre
|
ni
|
n0-ni= nac, i |
n0-ni= nac, i |
ni
|
.
14. Montrer que la quantité de matière finale d'ester dans le tube i à la date ti est ni = n0-CB VB i.
ni = n0-nac, i =n0-CB VB i.
Le tableau suivant regroupe les résultats :
tube i
|
1
|
2
|
3
|
4
|
5
|
6
|
V B i(mL)
|
15,3
|
11,3
|
9,3
|
7,3
|
6,3
|
6,3
|
ni mmol
|
17,3-15,3=2,0
|
6,0
|
17,3-9,3=8,0
|
10
|
11
|
11
|
15. Donner la valeur manquante.
17,3 -11,3 = 6,0.
16. Indiquer comment évolue la vitesse volumique d'apparition de l'ester au cours du temps.
17. Déterminer cette vitesse à t = 20 min.
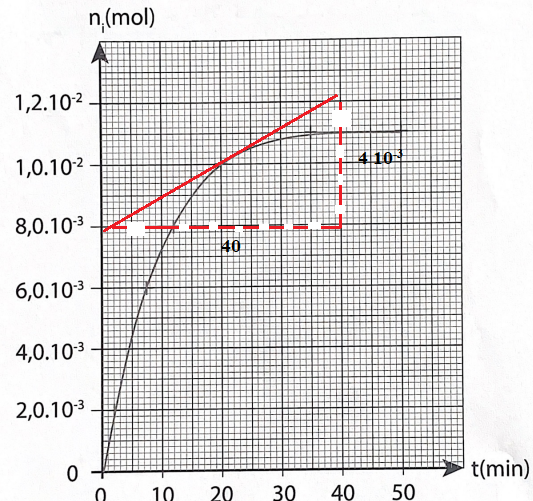
La vitesse volumique est égale à la valeur absolue du coefficient directeur de la tangente à la courbe à la date considérée.
Or ces tangentes sont de moins en moins inclinées sur l'horizontale. La
vitesse volumique de la réaction diminue au cours du temps.
A t = 20 min : 4 10-3 / 40 =1,0 10-4 mol min-1.
18. Déterminer le temps de demi-réaction..
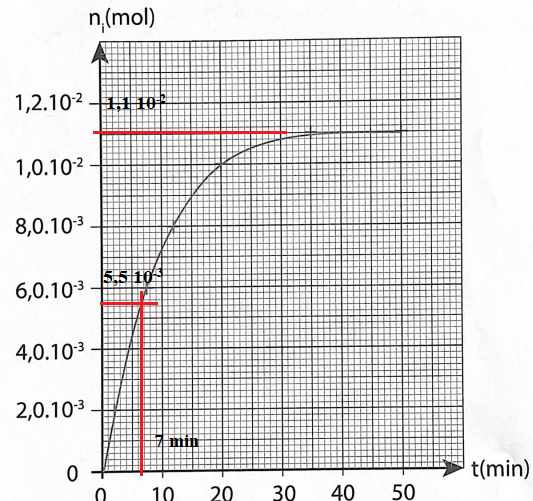
19. Comparer ce
temps à l'échelle de temps (plusieurs mois ) pour la production des
esters du vin. Proposer une explication à cet écart.
Paramètres pouvant avoir une influence sur t½ :
la température. ( le vin est conservé à des températures inférieures à 10°C).
Les concentrations des alcools et acides carboxyliques contenus dans le vin.
|
|