Partie 1 – Synthèse de l’acide barbiturique à partir de l’urée.
L’acide barbiturique et plus généralement les barbituriques constituent un groupe de médicaments qui
agissent sur le système nerveux.
De nos jours, l’acide barbiturique est synthétisé à partir d’urée et de malonate de diéthyle.
La synthèse de l’acide barbiturique est modélisée par la réaction (1) d’équation :
CH
4N
2O + C
7H
12O
4 → C
4H
4N
2O
3 + 2 C
2H
6O (réaction 1)
urée malonate de diéthyle acide barbiturique éthanol
On note l’acide barbiturique HA et sa base conjuguée A
−.
En tant qu’espèce ionique, cette base conjuguée
est soluble dans l’eau.
Le 𝑝𝐾
𝐴 du couple acide/base de l’acide barbiturique a pour valeur 4,08.
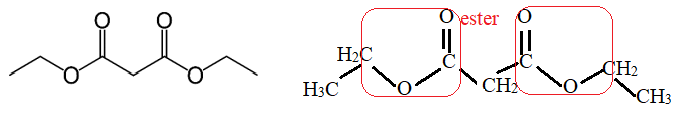
1. Écrire la formule semi-développée du malonate de diéthyle.
2. Sur la formule précédente, entourer le(s) groupe(s) caractéristique(s) du malonate de diéthyle et citer
la (ou les) famille(s) fonctionnelle(s) correspondante(s).
 Synthèse de l’acide balbiturique
Synthèse de l’acide balbiturique.
L'acide barbiturique peut être synthétisé à partir de l’urée, en milieu fortement basique, selon le protocole
suivant :
(a) Dans un ballon très sec, dissoudre à chaud 1,5 g d’urée (0,025 mol) et 0,5 g de sodium dans 10 mL
d'éthanol, puis ajouter 6,5 mL de malonate de diéthyle.
(b) Réaliser un chauffage à reflux du mélange.
(c) Après chauffage et refroidissement, ajouter 10 mL d'acide chlorhydrique (H
3O
+(aq), Cl
−(aq))
concentré. Laisser refroidir en plongeant le ballon dans un cristallisoir contenant de l’eau à 5°C : des
cristaux blancs (légèrement jaunâtres) d’acide barbiturique apparaissent lentement.
Réaliser une filtration sous vide puis rincer les cristaux avec de l’eau glacée.
(d) Réaliser une purification par recristallisation ; pour cela, récupérer les cristaux dans un erlenmeyer,
les dissoudre dans un minimum d'eau distillée bouillante et laisser refroidir lentement d'abord à l'air
puis dans un bain eau-glace. Filtrer à nouveau, rincer à l'eau glacée, sécher les cristaux et les mettre
à l'étuve sur un verre de montre taré.
(e) Peser les cristaux secs.
Après la mise en œuvre de ce protocole, la masse de produit recristallisé sec obtenu vaut 𝑚
𝑏 = 2,6 g.
3. Indiquer les deux intérêts du chauffage à reflux dans cette synthèse.
Le chauffage à reflux permet d'accélérer la réaction ( la température
est un facteur cinétique) tout en évitant les pertes de matière ( les
vapeurs se condensent dans le réfrigérant et retombent dans le milieu
réactionnel).
4. Justifier l’apparition de cristaux d’acide barbiturique lors de l’étape (c).
En milieu acide la forme AH prédomine ; l'acide barbiturique est soluble à chaud dans l'eau et peu soluble à froid.
5. Montrer que l’urée est le réactif limitant de la synthèse.
Malonate de diéthyle :masse (g) = volume(mL) x masse volumique(g / mL) =6,5 x1,05= 6,83 g.
Quantité de matière n = m / M = 6,83 / 160 =0,043 mol.
n(urée) = 0,025 mol, valeur inférieure à 0,043 mol.
L'urée est le réactif limitant.
6. Déterminer la masse théorique 𝑚
𝑏𝑡ℎ d’acide barbiturique que l’on pourrait obtenir si la synthèse était
totale.
Quantité de matière théorique d'acide barbiturique : 0,025 mol.
M( acide barbiturique) =128,0 g.
m
Bth = 0,025 x 128 ~3,2 g.
7. Exprimer puis calculer le rendement de cette synthèse.
Proposer des explications pour rendre compte du fait que le rendement est inférieur à 100 %.
Proposer une stratégie pour l’augmenter.
Rendement = masse réelle / masse théorique =
2,6 / 3,2 ~ 0,81 (81 %).
Lors des étapes de filtration, rinçage, recristallisation, il peut y avoir des pertes de matière.
Pour
augmenter le rendement il faut éliminer l'éthanol au fur et à
mesure de sa formation car l'acide barbiturique est un peu soluble dans
l'éthanol.
Contrôle de la pureté en acide barbiturique du produit recristallisé.
Afin de déterminer le degré de pureté du produit obtenu, on prépare une solution de volume
𝑉 = 100,0 mL de solution d’acide barbiturique par dissolution de 1,00 g de produit recristallisé obtenu à l’aide
de la synthèse précédente.
On procède ensuite au titrage de 100,0 mL de solution d’acide barbiturique préparée par une solution
d’hydroxyde de sodium (Na
+(aq), HO
−(aq)) de concentration 𝐶
𝐵 = 5,00 × 10
−1 mol ⋅ L
−1
. On suit le titrage
par pH-mètrie.
 8.
8. En utilisant la notation HA(aq) pour l’acide barbiturique en solution aqueuse et les résultats
expérimentaux, écrire l’équation de la réaction support du titrage.
HA aq + HO
-aq --> A
-aq + H
2O(l).
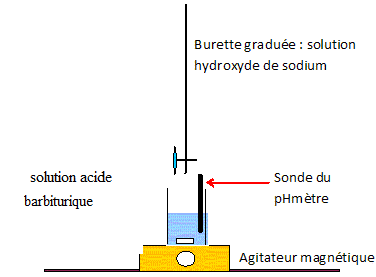
9. Schématiser et légender le montage permettant de réaliser le titrage de l’acide barbiturique par la
solution d’hydroxyde de sodium.
 10.
10. Rappeler la définition de l’équivalence d’un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoéchiométriques. Avant l'équivalence, l'acide est en
excès, après l'équivalence l'ion hydroxyde est en excès.
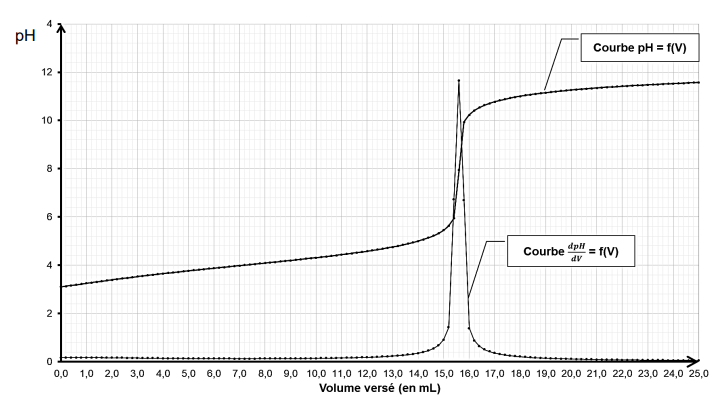
11. À partir des résultats du titrage, déterminer la masse en acide barbiturique présente dans 1,00 g de
solide recristallisé.
A l'équivalence : C
aV
a = C
b V
éq =0,500 x 15,5 = 7,75 mmol.
Masse d'acide barbiturique = 7,75 x 128 =992 mg = 0,992 g.
12. Préciser si la recristallisation a été satisfaisante. Justifier.
Degré de pureté de cet acide : 0,992 / 1 = 0,992 (99,2 %).
La recristallisation a été satisfaisante.