Une pile à combustible ( PAC) est un assemblage de cellules
élémentaires, comprenant deux électrodes contenant un catalyseur ( le
plus souvent du platine), séparées par un électrolyte, dont le rôle est
de permettre la migration des ions d'une électrode à l'autre.
Le comburant est du dioxygène. le combustible est le plus souvent du
dihydrogène. Ce combustible gazeux à température ambiante et
inflammable, pose des problèmes de stockage.
Un autre combustible possible est le méthanol. Ce combustible est
certes toxique, mais liquide à température ambiante. Il est produit
principalement à partir du gaz naturel. On se dispense ainsi du
problème de stockage du dihydrogène. Une telle pile à combustible
est appelée DMFC ( Direct Methanol Fuel Cells). L'électrolyte utilisé
est acide.
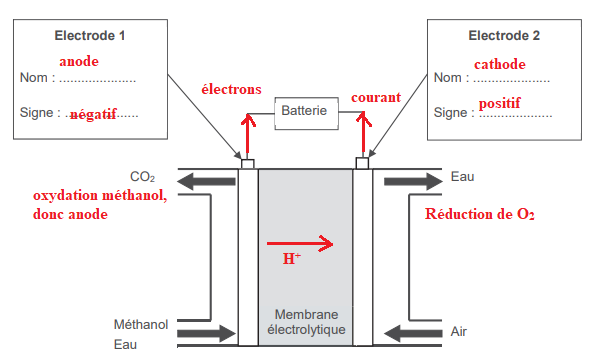 A. Etude du fonctionnement de la pile
A. Etude du fonctionnement de la pile.
Electrode 1 : CH
3OH aq +H
2O (l) = CO
2(g) +6e
- +6H
+aq.
Electrode 2 : O
2(g) +4e
- +4H
+aq = 2H
2O(l).
A1.1 Identifier l'anode et la cathode.
Une oxydation se produit à l'anode négative : électrode 1.
Une réduction se produit à la cathode positive : électrode 2.
A1.2 Indiquer le sens du courant électrique et les pôles de la pile.
Sens du courant électrique : de la cathode positive vers l'anode négative.
A1.3. Quel est le rôle de la membrane protonique ?
Cette membrane est riche en ion H
+.
Ces derniers sont consommés à l'électrode 1 et apparaissent à
l'électrode 2. Dans cette membrane, on observe le transfert des ions H
+ de l'anode vers la cathode.
A.1.4. Indiquer les sens des porteurs de charges à l'intérieur et à l'extérieur de la pile. ( voir schéma ci-dessus).
A.2. Tcrire l'équation de la réaction chimique modélisant le fonctionnement de la pile.
2 fois { CH3OH aq +H2O (l) = CO2(g) +6e- +6H+aq }
3 fois { O2(g) +4e- +4H+aq = 2H2O(l)}
Ajouter : 2CH3OH aq +2H2O (l) +3O2(g) +12e- +12H+aq= 2CO2(g) +12e- +12H+aq + 6H2O(l).
Simplifier : 2CH3OH aq +3O2(g) = 2CO2(g) + 4H2O(l).
La pile est alimentée par un volume V =5,0 mL d'une solution aqueuse de méthanol à 10 % en volume et avec de l'air ambiant.
A.3.1. Montrer que la quantité de matière de méthanol est n = 1,2 10
-2 mol.
Masse volumique du méthanol : 0,792 g / mL.
Masse de méthanol : 5,0 x0,792 = 0,396
g.
m(méthanol) = 32,0 g / mol.
n = 0,396 / 32 =
1,2 10-2 mol.
A.3.2. Justifier que le dioxygène est en excès.
Le dioxygène est issu de l'air, donc en large excès.
A.3.3 Déterminer le volume d'air consommé lors du fonctionnement de la pile.
n(O
2 ) =1,5 n(méthanol = 1,5 x1,2 10
-2 = 1,8 10
-2 mol.
Volume molaire : 24,5 L / mol.
Volume de dioxygène : 1,8 10
-2 x 24,5 =0,44 L.
l'air contient 20 % de dioxygène en volume.
Volume d'air : 0,44 / 0,20 =2,2 L.