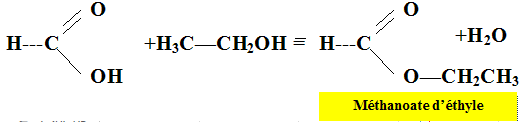Evolution
du sucre dans une boisson gazeuse, optimisation d'une synthèse, bac centres étrangers 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Evolution du sucre dans une boisson gaeuse.
Les sodas sont des solutions acides constituées principalement d’eau, de dioxyde de carbone et de saccharose dissous.
Lors
de leur fabrication, les industriels indiquent sur l’emballage une date
de durabilité minimale (DDM). Après cette date, le produit pourrait ne
plus correspondre auxstandards de qualité. Pour un soda, la DDM est
généralement de 3 mois.
Un soda acheté depuis longtemps est moins « riche en bulles » mais ce n’est pas la seule altération constatable.
En effet, le saccharose subit, en milieu acide, une hydrolyse qui est
une transformation totale conduisant à la formation de deux autres sucres, le glucose et
le fructose, modélisée par la réaction d’équation :
C12H22O11(aq) + H2O(ℓ) → C6H12O6(aq) + C6H12O6(aq)
saccharose S
glucose
fructose
Le mélange de glucose et de fructose a un pouvoir sucrant différent de
celui du saccharose d’où une modification de la saveur sucrée de la
boisson. La problématique de cet exercice est de déterminer le
pourcentage de
saccharose restant dans la boisson lorsque la DDM est atteinte.
On réalise en laboratoire la réaction d’hydrolyse du saccharose à une
température constante de 20°C et dans une solution tampon fixant le pH
à 2,5. On effectue un suivi de la réaction par une méthode physique
pour
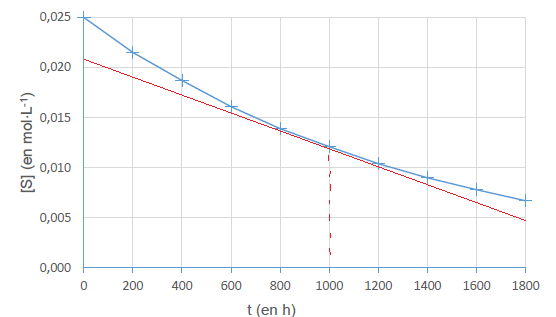
déterminer la concentration en saccharose, notée [S]. L’évolution
temporelle de la
concentration en saccharose est représentée.
1. Proposer une justification de l’utilisation d’une solution tampon de pH inférieur à 7 pour réaliser cette expérience.
Le saccharose subit, en milieu acide ( pH < 7), une hydrolyse qui est
une transformation totale.
2. Expliquer pourquoi les mesures effectuées ne permettent pas de répondre directement à la problématique.
Pour un soda, la DDM est
généralement de 3 mois, soit 3 x 30 x24 =6480 heures. Or l'étude est limitée à 1800 heures.
Pour
pouvoir estimer le pourcentage de saccharose restant lorsque la DDM est
atteinte, on souhaite modéliser l’évolution temporelle de sa
concentration [S]. On émet l’hypothèse que cette évolution suit une loi
de vitesse d’ordre 1 et on souhaite vérifier cette hypothèse.
3. Définir la vitesse volumique v de disparition du saccharose.
v = -d [S] / dt.
4.
Expliquer comment obtenir une estimation de la valeur de la vitesse
volumique de disparition du saccharose à un instant t donné à partir
des mesures réalisées.
L’explication peut être illustrée par la réalisation de cette estimation pour une date au choix du candidat.
Valeur absolue du coefficient directeur de la tangente à la courbe à une date donnée, par exemple pour t = 1000 h :
0,016 / 1800 ~8,9 10-6 mol L-1 h-1.
5.
Dans le cas d’une loi de vitesse d’ordre 1, rappeler la relation
existant entre la vitesse volumique de disparition v du saccharose, la
concentration en saccharose [S] et une constante de vitesse notée k.
v = - d [S] / dt = k[S].
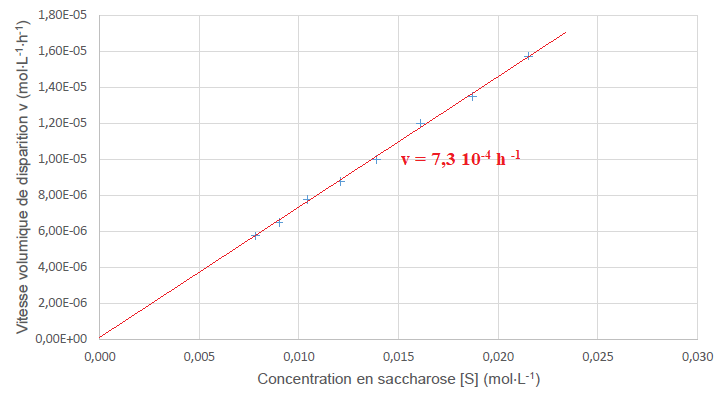
Sur le graphique suivant, l’évolution de la vitesse volumique v de
disparition du saccharose est représentée en fonction de la
concentration en saccharose [S].
6. Discuter de l’accord des mesures avec une loi de vitesse d’ordre 1.
Le graphe ci-dessus est une droite passant par l'origine. La
vitesse volumique v de disparition du saccharose est proportionnelle à
la concentration en saccharose [S]. En accord avec v = k[S].
7. Montrer que la constante de vitesse 𝑘 a une valeur de l’ordre de 7,3 ⋅ 10−4 h−1.
On détermine graphiquement le coefficient directeur de la droite.
Pour |S]= 0,0135 mol / L, v = 1,00 10-5 mol L-1 h-1.
k = 1,00 10-5 / 0,0135 ~7,4 ⋅ 10−4 h−1.
L’évolution de la concentration en saccharose s’écrit : [S] = [S]0 e-kt, [S]0 désigne la concentration initiale en saccharose.
8. Rappeler la définition du temps de demi-réaction noté t½
et montrer que, pour cette loi d’évolution, le temps de demi-réaction a
la propriété d’être indépendant de la concentration initiale en
saccharose.
A t½ la concentration du saccharose est égale à la moitié de la valeur initiale.
[S] =0,5 (S0] = [S0] exp(-kt½).
0;5 = exp(-kt½) ; ln(0,5) -ln(2)= -kt½ ; t½ = ln(2) / k.
9. Déterminer la valeur du temps de demi-réaction dans les conditions de l’expérience. Expliquer la démarche suivie.
t½ = ln(2) / (7,3 10-4) ~9,5 102 h.
10. Estimer le pourcentage de saccharose restant dans le soda lorsque la DDM de 3 mois est atteinte.
3 mois ~ 90 x24 =2160 heures.
[S] =0,025 exp(-7,3 10-4 x2160) =0,025 x0,02033 ~5,2 10-3 mol / L.
5,3 10-3 / 0,025 x 100 ~21 %.
|
...
|
....
|
Optimisation d'une synthèse.
Pour des raisons économiques, l’arôme de rhum des produits industriels est souvent d’origine synthétique.
Le méthanoate d’éthyle est un additif alimentaire à odeur de rhum. Il
est obtenu par la réaction entre l’acide méthanoïque et l’éthanol.
Cette transformation chimique est modélisée par la réaction d’équation
suivante :
CH2O2(ℓ) + C2H6O(ℓ) = C3H6O2(ℓ) + H2O(ℓ) en présence d'acide sulfurique.
L’objectif de l’exercice est de comparer deux protocoles permettant de réaliser cette synthèse.
Protocole 1 :
Dans un ballon de 250 mL contenant 1,20 mol d’éthanol, quatre gouttes de solution d'acide sulfurique concentré (H2SO4)
et quelques grains de pierre ponce, on ajoute 1,20 mol d’acide
méthanoïque. On chauffe à reflux jusqu'à l'obtention de tout l'ester
possible. À l’état final, le
mélange réactionnel contient 0,40 mol d’acide méthanoïque, 0,40 mol
d’éthanol, 0,80 mol de méthanoate d’éthyle et 0,80 mol d’eau.
Protocole 2 :
Dans un ballon, on mélange 37,7 mL d’acide méthanoïque, 29,1 mL
d’éthanol et 5 mL d’acide sulfurique concentré. On distille le mélange.
La température en tête de colonne augmente tout d’abord puis se
stabilise autour de 55 ° C. On cesse la récupération du distillat dès
que la température amorce une remontée. On obtient un volume de 32 mL
de distillat, dont on mesure la masse ; on obtient une valeur de 29,0 g.
1. Écrire les formules développées de l’acide méthanoïque, de l’éthanol et de l’ester impliqués dans la synthèse.
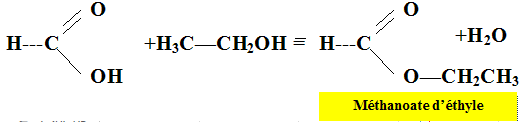
2. Citer deux facteurs mobilisés dans ces deux protocoles pour améliorer la cinétique de la synthèse.
La température et le catalyseur H2SO4.
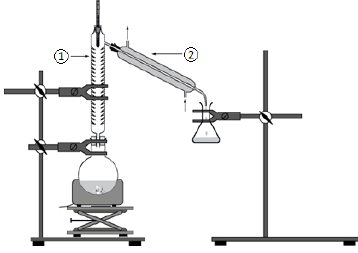
3. Indiquer auquel des deux protocoles correspond le schéma de la figure ci-dessus.
Protocole 2, montage de distillation fractionnée.
4. Donner les noms des éléments de verrerie numérotés 1 et 2 sur le montage.
1 : colonne vigreux ; 2 : réfrigérant à eau.
Comparaison des rendements des deux protocoles.
À partir du protocole 1 :
5. Justifier, sans calcul, que la synthèse n’est pas une transformation totale.
À l’état final, le mélange réactionnel contient 0,40 mol d’acide méthanoïque, 0,40 mol
d’éthanol, 0,80 mol de méthanoate d’éthyle et 0,80 mol d’eau.
6. Dresser un tableau d’avancement faisant apparaitre l’avancement final xf .
|
avancement (mol)
|
HCOOH
|
éthanol
|
ester
|
eau
|
initial
|
0
|
1,20
|
1,20
|
0
|
0
|
en cours
|
x
|
1,2-x
|
1,2-x
|
x
|
x
|
final
|
xf = 0,80
|
1,2-xf = 0,40
|
1,2-xf = 0,40 |
xf
|
xf |
7. Définir le rendement de la transformation chimique étudiée. Calculer le rendement pour ce premier protocole.
Rendement = quantité de matière expérimentale / quantité de matière théorique si réaction totale =0,80 / 1,20 ~0,67 (67 %).
Le rendement du protocole 2 est de 78 %.
8. Proposer deux arguments pour justifier ce fait.
Acide : d = 1,22 ; M =46 g / mol ; n = 37,7 x1,22 / 46 ~0,10 mol.
Ethanol : d = 0,79 ; M = 46 ; n = 29,1 x0,79 / 46 ~ 0,50 mol. ( en excès).
L'un des réactifs est en excès.
On élimine l'ester au fur et à mesure de sa formation.
Identification du produit du protocole 2.
On souhaite s’assurer que le distillat obtenu dans le protocole 2 est constitué de méthanoate d’éthyle.
9. Relever une
observation pendant l’expérience permettant de rendre compte du fait
que le distillat est constitué de méthanoate d’éthyle.
La température en tête de colonne augmente tout d’abord puis se stabilise autour de 55 ° C, température d'ébullition de l'ester..
10. Déterminer la masse volumique du distillat et discuter le résultat obtenu.
masse(g) / volume (mL) = 29,0 / 32 ~0,91 g / mL, en accord avec les données.
11. L’enregistrement
du spectre infrarouge du distillat obtenu lors de la mise en oeuvre du
protocole 2 est représenté . Discuter la compatibilité de ce spectre
avec l’espèce chimique attendue dans le distillat.
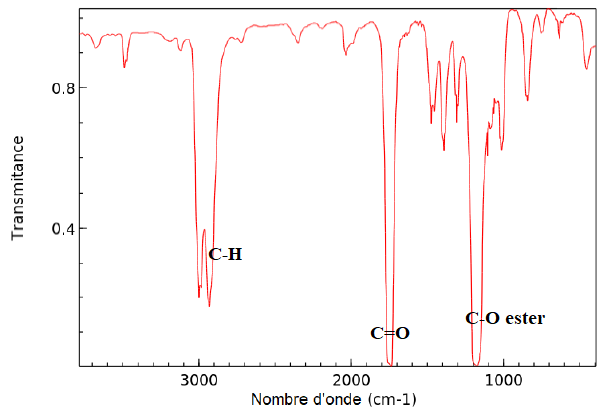
|
|