L'ammoniaque,
un produit ménager courant, bac centres étrangers 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
« L’ammoniaque » est une solution obtenue en dissolvant du gaz ammoniac, NH3(g), dans l'eau. Cette solution est présente dans de nombreux
produits d’entretien.
On
dispose d’une bouteille « d’ammoniaque » achetée dans le commerce dont
l’étiquette précise : « Ammoniaque concentration 13% ». « 13% »
correspond au titre massique de la solution commerciale en ammoniac.
On souhaite mettre en oeuvre un protocole permettant de déterminer la concentration en ammoniac dans la solution commerciale.
Données à 25°C :
- Masse molaire de l’ammoniac : M(NH3) = 17,0 g ⋅ mol−1
- Produit ionique de l’eau : Ke = 1,0 ⋅ 10−14
- Densité de la solution d’ammoniaque commerciale : d = 0,97
- couple acide-base : NH4+(aq)/NH3(aq), pKa = 9,2
Étude préliminaire : étude du couple ion ammonium / ammoniac.
L’ammoniac est très soluble dans l’eau.
1. Préciser si l’ammoniac est un acide ou une base en solution aqueuse.
Justifier.
L'ammoniac est suceptible de gagner un proton H+, c'est une base.
2. Écrire l’équation de la réaction modélisant la transformation mise
en jeu entre l’ammoniac dissous, NH3(aq), et l’eau.
NH3(aq) +H2O (l) = NH4+(aq) +HO-aq.
3. Donner la valeur de la constante d’acidité Ka du couple NH4+(aq)/NH3(aq). Rappeler la relation la liant, à l’équilibre, aux concentrations des espèces.
Ka = 10-pKa = 10-9,2 =6,3 10-10.
Ka =[NH3(aq)] [H3O+aq] / [NH4+(aq)] .
4. Tracer le diagramme de prédominance du couple NH4+(aq)/NH3(aq).
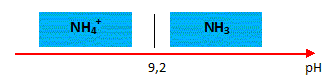
5. Expliquer comment retrouver le pKa du couple NH4+(aq)/NH3(aq). à partir du diagramme de distribution représenté ci-dessous.
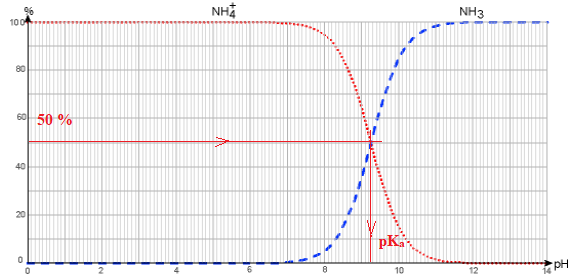
A pH = pK a, [NH4+(aq)] =[NH3(aq)].
Concentration attendue en ammoniac dans la solution commerciale.
6. À partir de la donnée
figurant sur l’étiquette, montrer que la concentration en quantité de
matière de l’ammoniac dans la solution commerciale est de l’ordre de
7,4 mol. L−1.
Masse d'un litre : 0,97 kg = 970 g.
Masse d'ammoniac : 970 x 0,13 =126,1 g.
Concentration 126,1 / M(NH3) =126,1 / 17,0 ~ 7,4 mol. L−1.
|
...
|
....
|
Titrage de la solution « d’ammoniaque » commerciale.
La solution S0 de la bouteille « d’ammoniaque » étant trop concentrée pour réaliser le titrage, une solution Sd, 100 fois moins concentrée est préparée et on réalise un titrage suivi par pH-métrie de cette solution diluée.
- On prélève un volume Vd = 10,0 mL de solution Sd.
- On titre ce prélèvement par une solution d’acide chlorhydrique (H3O+(aq), Cl−(aq)) de concentration CA = (5,00 ± 0,02) × 10−2mol ⋅ L−1.
Les résultats des mesures effectuées au cours du titrage et leur exploitation sont présentés ci-dessous.
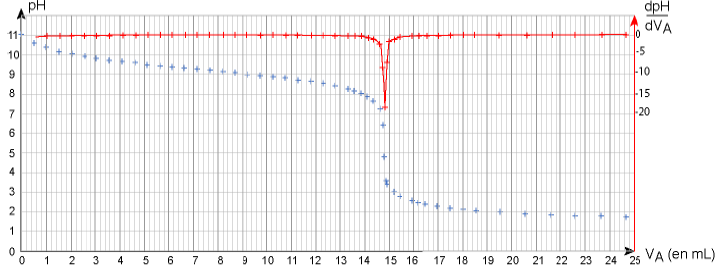
7. À partir des résultats expérimentaux,
- déterminer la valeur du pH de la solution Sd ;
Le pH initial est voisin de 11.
- déterminer l’espèce de couple ammonium/ammoniac prédominante au début du titrage, et celle prédominante à la fin du titrage ;
Au début, à pH supérieur à pKa, NH3 (aq) prédomine.
A la fin, à pH inférieur à pKa, NH4+(aq) prédomine.
- en déduire l’équation de la réaction acide-base support du titrage.
NH3(aq) + H3O+(aq) → NH4+(aq)+ H2O(ℓ)
8. Définir l’équivalence du titrage et déterminer le volume équivalent VE de ce titrage.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoéchiométriques. Avant l'équivalence, NH3(aq) est en excès, après l'équivalence H3O+(aq) ajouté est en excès.
Véq = 15 mL d'après le graphe.
9. Déterminer la valeur de la concentration Cd en ammoniac dans la solution Sd.
Cd Vd = CA Véq ; Cd = CA Véq / Vd =5,00 10-2 x 15,0 / 10,0 = 7,5 10-2 mol / L.
Les incertitudes-types sur les volumes prélevés sont estimées à 0,2 mL.
Par ailleurs, l’incertitude-type u(Cd) sur la concentration Cd se déduit des grandeurs mesurées par :
u(Cd) / Cd =[(u(VE) / VE)2 +(u(Vd) / Vd)2 +(u(CA) / CA)2 ]½.
Enfin, dans ces conditions expérimentales, le rapport entre la concentration C de la solution S0 de la bouteille « d’ammoniaque » et son incertitude u(C) est considéré comme étant le même qu’entre la concentration Cd de la solution diluée Sd et son incertitude u(Cd).
10. Déterminer la valeur de l’incertitude-type u(C) sur la concentration en ammoniac de la solution S0 commerciale. Écrire le résultat de la mesure de cette concentration C avec son incertitude.
u(Cd) / Cd =[(0,2) / 15)2 +(0,2) / 10)2 +(0,02 / 5)2 ]½= (1,78 10-4 +4 10-4 +1,6 10-5)½ ~2,4 10-2.
uC =2,4 10-2 x7,5 = 0,18 ~0,20 mol / L.
C = 7,5 ±0,2 mol / L.
11.
Confronter la valeur de la concentration déterminée expérimentalement
avec l’indication de l’étiquette de la bouteille « d’ammoniaque »
commerciale. Commenter.
C se situe dans l'intervalle [7,3 ; 7,7 mol / L]. L'indication de la bouteille, 7,4 mol / L appartient à cet intervalle.
L'indication de la bouteille est donc correcte.
|
|