L'acide
formique, bac centre étranger 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
A. Un
remède contre les piqures de fourmis
1. Entourer le
groupe caractéristique justifiant le terme acide..
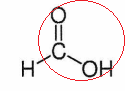
2. Justifier que l'acide formique se
nomme acide méthanoïque dans la nomenclature oficielle.
La chaine carbonée compte un seule atome de carbone d'où méthan.
C'est un acide carboxylique d'où acide méthanoïque.
3. Ecrire
l'équation de dissolution du carbonate de sodium dans l'eau.
Na2CO3 (s) --> 2Na+aq + CO32-aq.
4.
Ecrire uné équation de réaction qui met en évidence le rôle de l'ion
carbonate lors de son utilisation pour neutraliser l'acide formique.
CO32- joue le rôle de base.
CO32- aq + HCOOH aq -->
HCOO-aq + HCO3-aq.
B. Dosage d'un produit
commercial contenant de l'acide formique.
L'étiquette porte l'indication "65 % " pourcentage massique de la
solution en acide formique.
5. Montrer que la concentration de cette solution est C0
= 16,3 mol / L.
Densité de cette solution d = 1,15 ; M(HCOOH) = 46 g / mol.
Masse de 1 L de cette solution : 1,15 kg.
Masse d'acide formique : 0,65 x1,15 =0,7475 kg = 747,5 g.
Quantité de matière d'acide formique : 747,5 / 46 ~16,3 mol dans
1 L.
6. Citer deux règle
de sécurité à respecter lors de l'utilisation de cette solution.
Solution corrosive : port de blouse, gants et lunette de protection.
Pour effectuer le titrage on dispose d'une solution aqueuse d'hydroxyde
de sodium de concentration CB = 0,100 mol / L.
7. Ecrire la
réaction support du dosage.
HO-aq + HCOOH aq --> HCOO-aq + H2O(l)
8.
Définir l'équivalence et en déduire le volume équivlent Véq
de solution d"hydroxyde de sodium qu'il faudrait verser pour doser Va =
10 mL de solution commerciale. Commenter.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques.
Véq
= C0Va / CB =16,3 x 10 / 0,100 =1630
mL.
Ce volume est bien
trop grand pour être contenu dans une burette graduée. Il faut diluer
la solution commerciale.
9. Montrer qu'une dilution au 100ième
de la solurion commerciale permet de réaliser un dosage de 10 mL de
cette solution diluée avec un volume à l'équivalence compris
entre 15 et 20 mL.
Véq
= C1Va / CB =0,163 x 10 / 0,100 =16,3
mL.
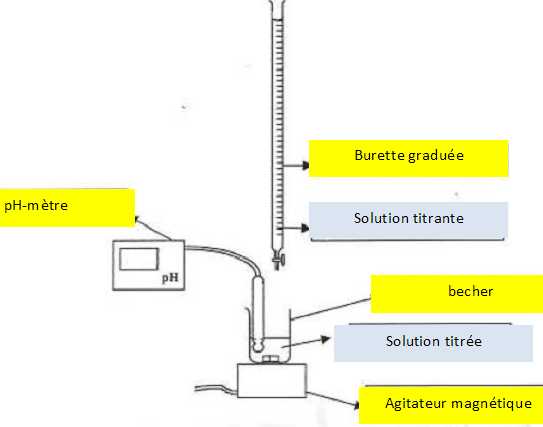
10. Faire un schéma
annoté du dispositif du titrage.
11. Déterminer si la solution d'acide formique commerciale est bien une solution à 65 %. Commenter.
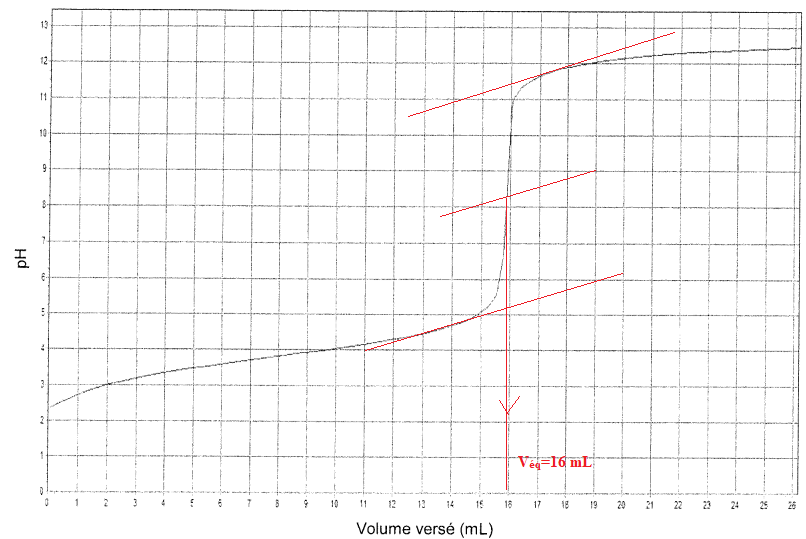
Cacide =CB Véq / Va =0,100 x 16 / 10 =0,16 mol / L.
Tenir compte de la dilution au centième : 0,16 x100 =16 mol / L
Ecart relatif (16,3 -16) / 16,3 x100 ~ 2 %.
Cet écart étant très faible, la solution d'acide formique commerciale est bien une solution à 65 %.
|
...
|
....
|
C. Synthèse du formiate d'éthyle C3H6O2.
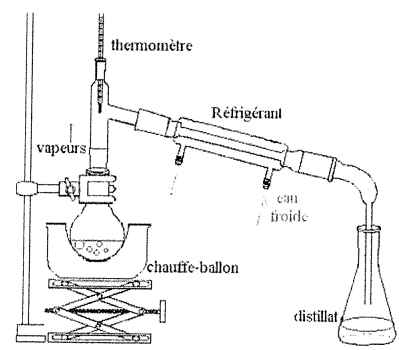
Protocole :
Placer dans un ballon, sous agitation, 20 mL d'acide formique et 20 mL d'éthanol.
Ajouter 2 mL d'acide sukfurique. Réaliser le montage ci-dessous puis chauffer le mélange à ébullition douce.
Quand les premières gouutes de distillat tombent dans l'erlenmeyer, la température en tête de colonne vaut 55°C.
12. Indiquer le rôle du catalyseur.
Le catalyseur permet d'atteindre plus rapidement l'équilibre sans en changer la composition.
13. Donner une raison pour laquelle il est nécessaire de chauffer.
La température est un facteur cinétique ( l'estérification est lente).
En chauffant cela permet d'éliminer l'ester au fur et à mesure de sa formation. L'équilibre est déplacé dans le sens direct.
14. Montrer que les quantités initiales de réactifs sont nacide = 0,53 mol ; n alcool = 0,35 mol.
Acide formique : 1,22 g / mL ; masse 20 x1,22 = 24,4 g ;
nacide = 24,4 / M(acide formique) = 24,4 / 46 =0,53 mol.
Ethanol : 0,81 g / mL ; masse 20 x 0,81 = 16,2 g ;
nalcool = 16,2 / M(éthanol) = 16,2 / 46 =0,35 mol.
15. Quel est l'intérêt d'utiliser un réactif en excès ?
On déplace l'équilibre dans le sens direct, formation de l'ester. Ainsi, on augmente le rendement.
16. Quelle masse théorique d'ester peut-on obtenir ?
0,35 mol soit 0,35 M(ester) = 0,35 x 74 =25,9 ~26 g.
17. On obtient expérimentalement m = 22,5 g d'ester. En déduire la quantité de matière d'ester.
22,5 / 74 =0,304 mol.
18. Calculer le rendement.
Quanttité de matière réelle / quantité de matière expérimentale = 0,304 / 0,35 ~0,87.
19. Justifier l'intérêt de ce montage.
En chauffant cela permet d'éliminer l'ester ( Téb = 55 °C), espèce la plus volatile, au fur et à mesure de sa formation. L'équilibre est déplacé dans le sens direct.
20. Déterminer la masse volumique du distillat et émettre une hypothèse sur sa pureté.
Volume distillat V = 25,1 mL ; masse volumique = masse / volume = 22,5 / 25,1 =0,896 g / mL.
Valeur théorique 0,92 g / mL.
Le distillat n'est pas pur.
21. A partir de l'analyse du spectre IR, dire si cette hypothèse est confirmée.
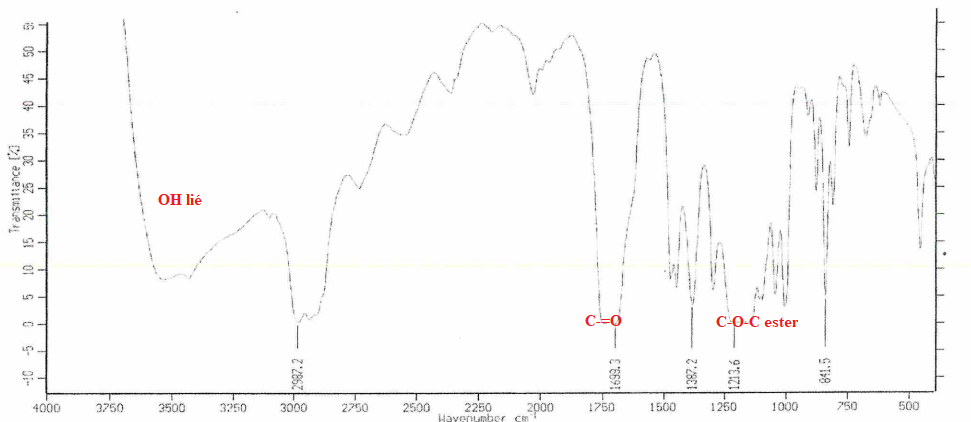
La bande large vers 3300 cm-1 indique la présence d'éthanol dans le produit obtenu ; celui-ci n'est pas pur.
|
|