La vitamine C
Partie 1 : Solubilité de la
vitamine
1.1. Définir les termes
"liposolubles" et "hydrosolubles".
Une espèce liposoluble est soluble dans les graisses.
Une espèce
hydrosoluble est soluble dans l'eau.
1.2. Préciser dans
quel type de tissus sont stockées les vitamines liposolubles.
Les vitamines
liposolubles.sont stockées dans le foie et les tissus adipeux.
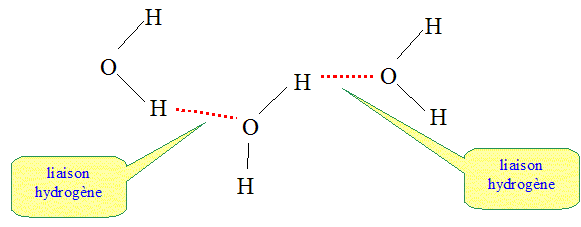
1.3. Schématiser par un
trait pointillé la liaison hydrogène qui
peut s'établir entre deux molécules d'eau.
 1.4.
1.4. En déduire le
caractère hydrosoluble de la vitamine C.
La molécule de vitamine C possédant plusieurs groupes OH, peut établir
des liaisons hydrogène avec les molécules d'eau.
La vitamine C est hydrosoluble.
De la vitamine C dans un
jus d'orange.
Afin de comparer la concentration en vitamine C d’un jus d’orange
fraîchement pressé (noté F)
et d'un jus pasteurisé (noté P), on effectue le dosage par titrage d'un
même volume V
J de jus
d’orange à l’aide de DCPIP (2,6-dichlorophénol-indophénol).
Le DCPIP est un réactif de couleur rose qui réagit mole à mole avec la
vitamine C. Lors de
cette réaction, les produits obtenus sont incolores. À l'équivalence du
titrage, on observe la
persistance de la coloration rose dans la solution titrée.
Volume de jus titré : V
J = 5,0 mL
Concentration en quantité de matière de DCPIP : C
DCPIP =
1,0×10
-3 mol·L
-1
Masse molaire de la vitamine C : M = 176 g·mol
–1
Volumes de DCPIP versés à l’équivalence pour le jus frais F : V
E
= 10,0 mL
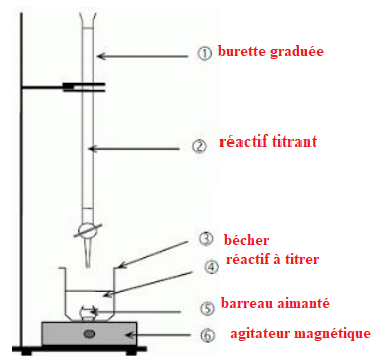
2. Associer les numéros du schéma ci-contre au
vocabulaire suivant : agitateur magnétique, barreau aimanté,
bécher, burette graduée, réactif à titrer, réactif titrant.
 3.
3. Justifier
l'observation effectuée à l'équivalence du titrage.
Avant l'équivalence, le réactif titrant est en défaut et les produits
de la réaction sont incolores. Solution incolore dans le bécher.
Après l'équivalence, le réactif titrant est en excès, solution rose
dans le bécher.
4. La relation vérifiée à
l’équivalence du titrage par les
concentrations en quantité de matière est :
C
DCPIP × V
E = C
Vit C,F × V
J
où V
E est le volume de DCPIP versé à l’équivalence.
Déterminer la concentration en quantité de matière de
vitamine C notée C
Vit C,F, dans le jus frais F.
CVit
C,F =CDCPIP
× VE / VJ
o =1,0 10-3 x 10,0 / 5,0 = 2,0 10-3 mol / L.
5. Montrer
que la concentration en masse C
m(Vit C, F) de vitamine C
dans le jus frais est voisine
de 350 mg·L
–1
.
Cm(Vit C,
F) =CVit C,F x M = 2,0 10-3 x176
=0,35 g / L ou 350 mg / L.
6. La pasteurisation est
un procédé de conservation des aliments par chauffage, puis
refroidissement. La concentration en masse de vitamine C dans le jus
pasteurisé a pour
valeur C
m(Vit C, P) = 56 mg·L
-1 .
6.1. Comparer cette
valeur à celle calculée pour le jus frais et commenter l’effet de la
pasteurisation.
Cette valeur est environ 6 fois plus faible que dans le jus frais.
Le chauffage détruit une partie de la vitamine C.
6.2. Calculer le
volume de jus d'orange pasteurisé nécessaire pour couvrir les besoins
journaliers en vitamine C ( 100 mg par jour ).
100 / 56 ~1,8 L de jus pasteurisé.
2.
6.3. Proposer un argument favorable à la consommation de fruits
frais pour l’apport de vitamine C.
Il est quasiment impossible de boire 1,8 litres de jus d'orange
pasteurisé par jour. Par contre in peut manger des fruits frais et des
légumes verts frais pour avoir le même apport en vitamine C.