L"acide
lactique, bac STL 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
L’objectif de cet exercice est d’étudier la structure de l’acide lactique et d’identifier
l’espèce prédominante sous laquelle se trouve l’acide lactique dans le sang des
muscles au cours d’efforts intenses.
PARTIE A – Structure de la molécule d’acide lactique.
La formule semi-développée de la molécule d’acide lactique est donnée ci-dessous :
A.1. Nommer les familles fonctionnelles associées aux groupes caractéristiques .
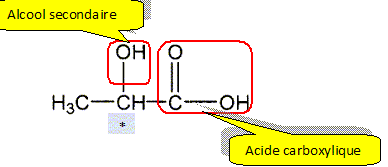
A.2. En justifiant votre réponse, donner l’adjectif utilisé pour qualifier l’atome de
carbone noté « * » dans la formule semi-développée donnée ci-dessus.
Atome de carbone asymétrique : atome de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
Des travaux menés depuis la découverte de Jöns Jacob Berzelius ont permis
d’établir que l’acide lactique présent dans le sang des muscles lors d’efforts intenses
est uniquement sous forme de l’énantiomère de stéréodescripteur S.
A.3. La molécule d’acide lactique présent dans le sang des muscles est qualifiée de
molécule « chirale ». Donner la définition du mot « chirale ».
Cette molécule n'est pas superposable à son image dans un miroir.
A.4. Reproduire sur la copie et compléter la répresentation ci-dessous pour
représenter le stéréoisomère concerné. Expliquer votre démarche et les règles
appliquées.
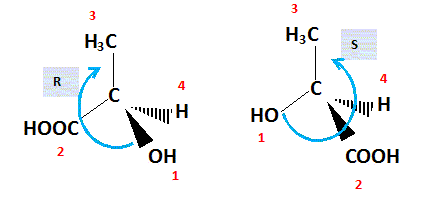 A.5. Montrer que l’acide lactique S est chiral.
A.5. Montrer que l’acide lactique S est chiral.
Cette molécule possède un atome de carbone asymétrique.
PARTIE B – Acide lactique dans le sang
Une masse m = 500 mg d’acide lactique est dissoute dans de l’eau distillée pour
obtenir une solution de volume V = 100,0 mL. Le pH de la solution obtenue est
mesuré ; la valeur obtenue est : pH = 2,6.
B.1. Montrer que la concentration en quantité de matière CA apportée en acide
lactique dans la solution préparée vaut CA = 5,6 10-2 mol L
-1
.
Masse molaire acide lactique M = 90 g / mol.
n = m / M =0,500 / 90 =5,55 10-3 mol.
CA = n / V = 5,55 10-3 / 0,100 =5,6 10-2 mol L
-1
.
B.2. Justifier le caractère acide de l’acide lactique.
Le pH de la solution est inférieur à 7.
B.3. En déduire la formule semi-développée de l’ion lactate, base conjuguée de
l’acide lactique.
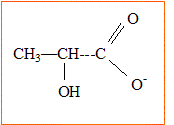 B.4. Écrire l’équation de la réaction acido-basique entre l’acide lactique et l’eau.
B.4. Écrire l’équation de la réaction acido-basique entre l’acide lactique et l’eau.
On note AH l'acide lactique.
AH aq + H2O l = A-aq + H3O+aq.
B.5. Montrer que le coefficient de dissociation de l’acide lactique s’écrit :
a = [H3O+aq] / CA.
a = [A-aq] / CA.
La solution est électriquement neutre : [A-aq] =[H3O+aq]
B.6. Calculer a et justifier que l’acide lactique est un acide faible.
a = 10-2,6 / (5,6 10-2) =0,045.
a est très inférieur à1, l'acide lactique est un acide faible.
B.7. Représenter le diagramme de prédominance du couple acide lactique / ion
lactate et déduire l’espèce prédominante de l'acide lactique dans la solution
préparée.
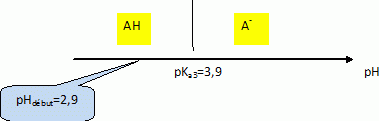
A pH inférieur à pKa, la forme AH prédomine.
B.8. Donner l’expression de la constante d’équilibre acido-basique Ka du couple
acide lactique/ion lactate dans l’eau en fonction des concentrations à l’équilibre des
espèces chimiques concernées.
Ka = [A- ]éq [H3O+]éq / [AH]éq.
B.9. À partir de l'expression de Ka, montrer que le rapport [A-
]éq
/ [AH]éq
est
environ égal à 5,0 10–2.
Vérifier la cohérence de ce résultat avec la réponse
formulée à la question
[A-
]éq
/ [AH]éq = Ka / [H3O+]éq =10-3,9 / 10-2,6=10-1,3 =0,050.
L'espèce AH est majoritaire à pH = 2,6, en accord avec la question B7.
B.10. Conclure quant à l’espèce chimique du couple acide lactique/ion lactate
prédominante dans le sang après un effort intense.
pH du sang = 7,4.
A pH > pKa, la forme A- prédomine.
|