Hydrolyse
du saccharose, acides aminés, Bac STL 09 / 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Le saccharose, de formule brute C 12H 22O 11,
est l'unique composant du sucre de table, quelle que soit sa forme
(cristallisé, semoule, en grains, en morceaux, ...). Issu
principalement de la culture de la betterave sucrière et de la canne à
sucre, on le retrouve dans de nombreux produits sucrés.
Lors de son ingestion, le saccharose est hydrolysé par les sucs
gastriques et libère, en quantités équimolaires, du fructose et du
glucose, deux isomères de formule brute C 6H 12O 6.
L’hydrolyse du saccharose en solution aqueuse peut être modélisée par
la réaction d’équation suivante :
C 12H 22O 11(aq) + H 2O(l) → C6H12O6(aq) + C6H12O6(aq).
En présence d’un acide, l’hydrolyse se produit partiellement, voire
totalement, au cours du temps. Cette transformation chimique du
saccharose est extrêmement lente.
Les boissons de type soda ont pour conservateurs les plus courants
l’acide citrique et l’acide phosphorique. Plus la boisson est acide,
plus l'hydrolyse du saccharose qu’elle contient est rapide.
On considère une canette de soda de 330 mL contenant 35 g de saccharose
dont on étudie la transformation par hydrolyse au cours du temps.
Donnée : masse molaire du saccharose M = 342 g.mol-1.
1. Calculer la
quantité de matière de saccharose contenue dans le volume de soda de la
canette et en déduire que sa concentration initiale en quantité de
matière de saccharose, notée [A]0, est environ égale à 0,3
mol.L-1.
35 / 342 =0,102 mol ; [A]0 = 0,102 / 0,330 ~0,3 mol / L.
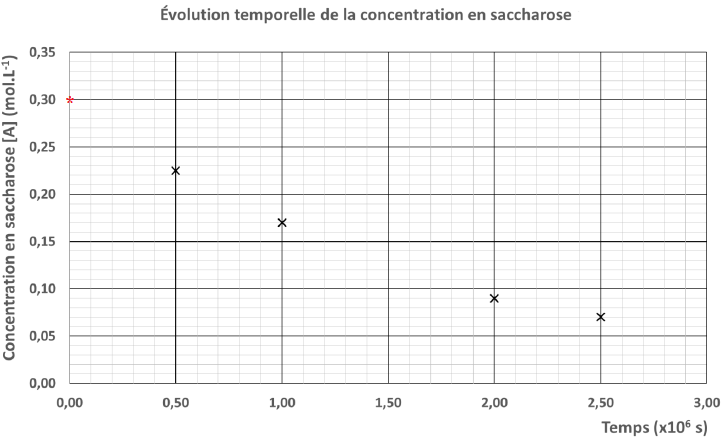
Au cours de l’étude
expérimentale de la transformation au cours du temps du saccharose,
deux représentations de l’évolution de sa concentration, notée [A], en
fonction du temps ont pu être tracées.
2. Compléter
chacune des deux représentations en utilisant la valeur de la
concentration initiale en
saccharose [A]0 obtenue à la question précédente.
L’évolution de la concentration d’une espèce E en fonction du temps
peut notamment être donnée par l’une des relations suivantes selon la
loi de vitesse de la transformation chimique étudiée :
Réaction d’ordre 0 : [E] = [E]0 − 𝑘𝑡 (relation 1)
Réaction d’ordre 1 : ln[E] = ln[E]0 − 𝑘𝑡 (relation 2)
où 𝑘 est la constante de vitesse de la transformation chimique étudiée
et [E]0 la concentration initiale de l’espèce E.
3. Expliquer
pourquoi les résultats expérimentaux tranchent en faveur d’une loi de
vitesse d’ordre 1, plutôt que d’ordre 0, pour l’hydrolyse du saccharose.
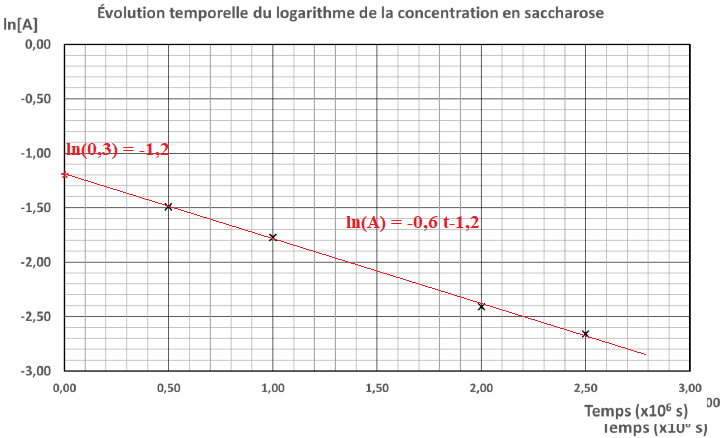
Les points étant alignés, les résultats sont en faveur d'une réaction
d'ordre 1.
4. Déterminer
graphiquement la valeur de la constante de vitesse 𝑘 de cette réaction.
Indiquer, sur la courbe choisie, les points utilisés pour le calcul.
k = (-2,7 -(-1,2)) / 2,50= -0,6 µs-1.
Par la suite, on note f la fonction définie sur l’intervalle [0 ; +∞[
modélisant, en fonction du temps t, exprimé en secondes, la
concentration de saccharose f(t), exprimée en mol.L-1.
Pour une évolution de la concentration donnée par une relation d’ordre
1, les données physiques de l’expérience conduisent à résoudre
l’équation différentielle (E) :
𝑦′ = −6. 10−7𝑦
5. Déterminer la
fonction f solution de l’équation différentielle (E) telle que f(0) =
0,3.
Solution de (E) : f(t) = A exp(-6 10-7 t) avec A une
consatnte.
f(0) = A = 0,3.
f(t) = 0,3
exp(-6 10-7 t).
Par la suite, la fonction 𝑓 est définie sur l’intervalle [0 ; +∞[ par f(t) = 0,3 exp(-6 10-7 t).
6.
Calculer la concentration en quantité de matière de saccharose dans la
canette de soda au bout de 60 jours. Commenter le résultat.
t = 60 x 24 x3600 =5,184 106 s.
f(5,184 106
) = 0,3 exp(-6 10-7 x 5,184 106) =1,34 10-2
mol / L.
(0,3 -0,0134) / 0,3 ~0,95 ; 95 % du saccharose initial est hydrolysé.
|
...
|
....
|
Acides aminés
Les acides aminés ont une importance considérable, notamment dans le
domaine de la biochimie. Outre des fonctions chimiques communes, leurs
structures peuvent comporter des chaînes carbonées plus ou moins
longues, éventuellement cycliques.
On s’intéresse à deux acides aminés linéaires à courtes chaînes
carbonées : l’alanine et la glycine, dont les molécules sont
représentées ci-dessous.
1. Justifier
l’appartenance de chacune de ces deux molécules à la famille des acides
aminés en entourant et en nommant sur les groupes
caractéristiques responsables.
Chaque molécule possède une fonction amine et une fonction acide
carboxylique. Ce sont des acides aminés.
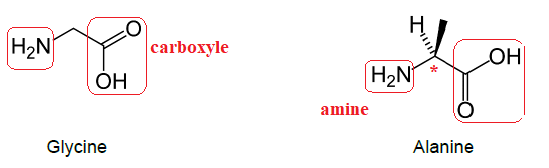
2. L’une de ces
deux molécules est chirale. L’identifier, avec justification.
L'alanine possède un atome de carbone asymétrique. Elle est chirale.
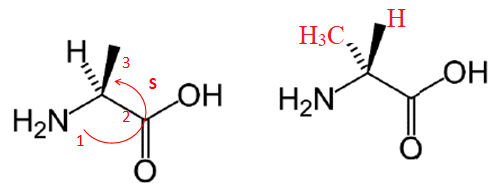
3. Déterminer la
configuration absolue correspondante en explicitant clairement votre
démarche. On donne les numéros atomiques Z(H) = 1, Z(C) = 6, Z(N) = 7
et Z(O) = 8.
4. Représenter, en
perspective de Cram, son énantiomère.
La glycine, comme tous les acides aminés, est une espèce amphotère,
c’est-à-dire acide
et basique à la fois. Elle forme en solution aqueuse les espèces des
deux couples acide /base suivants dont on fournit les pKa à 20 °C :
pKa (+H3N – CH2 – COOH / +H3N
– CH2 – COO-) = 2,4
pKa (+H3N – CH2 – COO- / H2N – CH2
– COO-) = 9,7.
5. Écrire les deux
équations modélisant l’échange de proton entre les deux espèces
conjuguées de chacun des deux couples de la glycine.
+H3N – CH2 –
COOH +H2O--> +H3N – CH2
– COO- +H3O+.
+H3N
– CH2 – COO- +H2O--> H2N
– CH2 – COO-+H3O+.
6. Donner,
pour chaque couple, l’expression de la relation liant les
concentrations des espèces conjuguées du couple au pH de la solution et
au pKa du couple.
pH=pKa1 + log( [+H3N
– CH2 – COO- ] / [+H3N – CH2 –
COOH] )
pH=pKa2 + log( [H2N – CH2 – COO- ] /
[+H3N
– CH2 – COO- ] )
7.
En déduire le diagramme de prédominance de la glycine. Vérifier qu’il
comporte trois domaines correspondant aux trois espèces des deux
couples acide-base auxquels appartient la glycine.
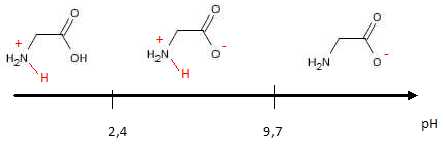
La littérature
scientifique indique que les acides aminés, dont les pKa sont tous
proches les uns des autres
(valeurs d’environ 2 à 3 et 9 à 10), sont présents dans le sang sous forme de zwitterions.
8. Déterminer, sans calculs, quelle
est l’espèce prédominante de la glycine dans le sang à pH = 7,4. En déduire une possible
définition d’un zwitterion.
La forme +H3N – CH2 – COO-
prédomine à pH = 7,4.
Un zwitterion est un composé neutre possédant en nombre égal des
charges électriques formelles d'une unité et de signes opposés.
9.
À 37°C, le produit ionique de l’eau dans le sang, noté Ke, est égal à
1,9.10-14. En déduire
le caractère acide ou basique du sang à cette température.
pH neutre à cette température : - 0,5 log( 1,9.10-14)
=6,86.
Le sang est donc basique.
Le sang est un
milieu dont le pH doit être compris entre 7,35 et 7,45. Des systèmes tampons, comme l’histidine et le tampon
phosphate, assurent une valeur moyenne du pH du sang de 7,4.
10. Définir ce qu’est une solution
tampon en indiquant ses propriétés.
Une solution tampon est constituée d'un acide faible et de sa base
conjuguée en quantités telles que le pH est proche du pKa du couple acide / base..
Une solution tampon modère les variations de pH suite à l'ajout modéré
d'un acide ou d'une base, suite à une dilution modérée.
|
|