La
vitamine C, bac Amérique du Nord 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
La vitamine C, ou acide ascorbique, joue un rôle
essentiel dans le métabolisme, dans la lutte contre
les affections virales ou bactériennes, l’assimilation
du fer… Elle ne peut pas être produite par
l’organisme, mais on la trouve dans de nombreux
aliments (fruits, légumes, œufs, beurre, etc.) dans
des quantités variables. Dans le commerce, on
trouve de l’acide ascorbique sous forme de
comprimés contenant de l’aspartame. L’aspartame,
édulcorant de synthèse, est choisi pour son haut
pouvoir sucrant et sa faible teneur en calories.
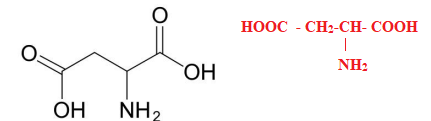
A. La molécule d’aspartame et un précurseur de sa synthèse, l’acide aspartique.
A.1. Trois groupes
caractéristiques présents dans l’aspartame sont entourés. Nommer la famille
fonctionnelle correspondant à chaque groupe caractéristique.
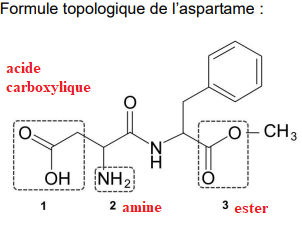
L’aspartame peut être synthétisé en laboratoire à partir de l’acide aspartique dont la formule
topologique est donnée ci-dessous :
A.2. Représenter la formule semi-développée de l’acide aspartique.
Les spectres, obtenus par spectroscopie infrarouge, de l’aspartame et de l’acide aspartique sont
présentés ci-après :
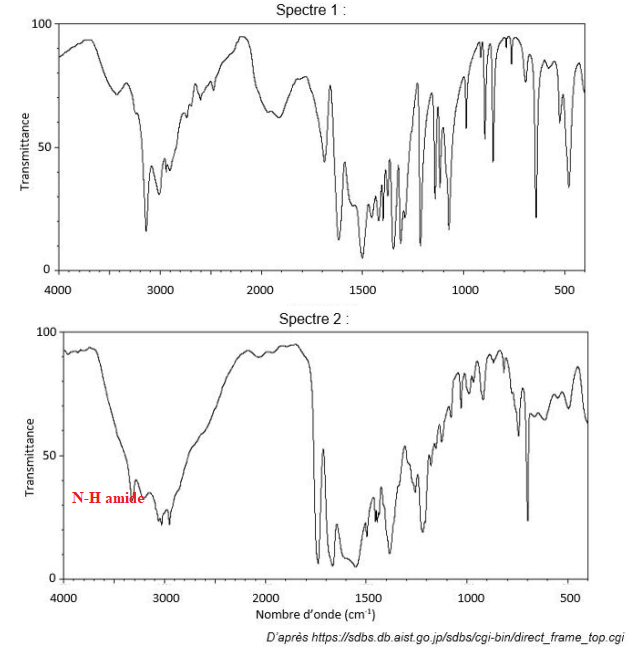
A.3. À l’aide de la table des nombres d’onde de vibrations de valence, identifier le spectre de
l’aspartame. Justifier le choix.
Sur le spectre 2, on distingue les bandes caractéristiques de la fonction amide de l'aspartame.
B. Une étape de la synthèse de l’aspartame.
La synthèse de l’aspartame nécessite une dizaine d’étapes. Une des premières étapes, consiste
à transformer l’espèce chimique (A) pour former l’espèce chimique (C) :
A C12H13O6N(s) +B C7H8O(l) -->C C19H19O6N(l) + H2O(l)
Plusieurs protocoles effectués à la même température sont envisagés. Les résultats
expérimentaux sont présentés dans le tableau ci-dessous :
protocole
|
Masse A(g)
|
Masse B(g)
|
Masse C(g)
|
rendement %
|
durée (h)
|
présence palladium
|
1
|
3,00
|
9,63 10-3
|
4,12
|
?
|
1
|
oui
|
2
|
2,57
|
3,44
|
80
|
1
|
oui
|
3
|
2,57
|
3,44
|
80
|
2
|
non
|
M(A)=267 g / mol ; M(B) = 108 g / mol , M(C) =447 g /mol. Masse volumique B : r = 1,04 g / mL.
B.2. Déterminer la valeur du rendement de la synthèse avec le protocole 1.
Quantité de matière A : n = 3,00 / 267 =1,12 10-2 mol.
Quantité de matière C : 1,12 10-2 mol. Masse théorique de C : 1,12 10-2 x 447 =5;02 g.
Rendement : 4,12 / 5,02 =82 %.
B.3. Expliquer pourquoi la valeur du rendement du protocole 1 est supérieure à celle du
protocole 2. Proposer un autre protocole pour améliorer ce rendement.
La masse du réactif A est plus important dans le protocole 1. La quantité de matière des réactifs est un facteur cinétique.
Pour augmenter le rendement, on peut éliminer l'eau au fur et à mesure de sa formation.
B.4. En exploitant les informations du tableau précédent, identifier le rôle joué par le palladium
sur carbone. Justifier.
Protocole 3 : pour obtenir le même rendement en absence de catalyseur il faut une durée double de celle du protocole 2.
Un catalyseur permet d'atteindre plus rapidement l'équilibre sans en changer la composition.
|
...
|
....
|
C. L’acide ascorbique.
L’acide ascorbique est un acide faible de formule C6H8O6.
On dissout un comprimé de 0,50 g d’acide ascorbique dans l’eau. Le volume de la solution
obtenue est de 200,0 mL.
Données :
- masse molaire de l’acide ascorbique M = 176 g·mol-1
;
- conductivités ioniques molaires : mS m2 mol-1 :
ion C6H7O6
-
: 3,42. Na+ 5,01. HO- 19,9.
C.1. Choisir, parmi les trois propositions suivantes, la valeur de la concentration c en quantité
de matière apportée d’acide ascorbique en justifiant la réponse :
a. 1,4 × 10-5 mol·L-1 ; b. 1,4 × 10-2 mol·L-1 ; c. 2,5 mol·L-1
.
Quantité de matière n = 0,50 / 176 =2,84 10-3 mol.
Concentration n / V =2,84 10-3 / 0,200 =1,4 10-2 mol / L.
C.2. Écrire l’équation de la réaction modélisant la transformation prenant place entre l’acide
ascorbique et l’eau.
C6H8O6 aq + H2O(l) = C6H7O6 - aq +H3O+aq.
La valeur du pH à l’équilibre de la solution obtenue en dissolvant le comprimé est de 2,9.
C.3. Montrer qu’à l’équilibre, la constante d’acidité Ka peut s’écrire :
Ka =
[H3O+aq]
éq
2
/ ((c - [H3O+aq]
éq
) × c°)
avec c°= 1 mol·L-1
la concentration standard et c la concentration en quantité de matière
apportée d’acide ascorbique.
Ka =
[H3O+aq]
éq [C6H7O6 - aq]éq / [C6H8O6 aq ]éq.
La solution est électriquement neutre et HO- est négligeable à pH = 2,9.
[H3O+aq]
éq =[C6H7O6 - aq]éq .
Conservation de l'élément carbone : [C6H7O6 - aq]éq +[C6H8O6 aq]éq = c.
C.4. Déterminer la valeur de la constante d’acidité Ka puis le pKa du couple acide
ascorbique/ion ascorbate.
Ka = (10-2,9)2 / (1,4 10-2 -10-2,9) =1,2 10-4 ; pKa = -log(1,2 10-4) =3,9.
C.5. Représenter le diagramme de prédominance du couple ascorbique/ion ascorbate et en
déduire la forme majoritaire de ce couple dans l’estomac où le pH vaut environ 2.
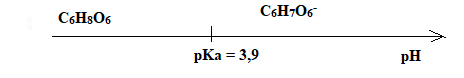
A pH inférieur à pKa, la forme C6H8O6 prédomine.
Le fabricant fournit les informations suivantes :
Ce que contient LAROSCORBINE 500 mg SANS SUCRE, comprimé à croquer édulcoré à l’aspartame.
Pour un comprimé à croquer, les substances actives sont :
Vitamine C: 500,00 mg
Sous forme d’acide ascorbique 200,00 mg
Sous forme d’ascorbate de sodium 337,40 mg.
On souhaite vérifier l’information concernant la masse d’acide ascorbique présent dans un
comprimé.
On dissout un comprimé de vitamine C dans l’eau distillée pour obtenir une solution S de volume
V0 égal à 250,0 mL.
On prélève un volume V = 40,0 mL de cette solution S que l’on titre par un
suivi conductimétrique avec une solution d’hydroxyde de sodium de concentration en quantité de
matière cB = 2,00 × 10-2 mol·L
-1
.
C.6. Écrire l’équation de la réaction support du titrage.
C6H8O6 aq + HO-aq --> C6H7O6 - aq +H2O(l)
C.7. Réaliser un schéma légendé du dispositif expérimental du titrage.
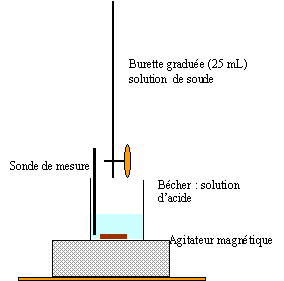
La courbe ci-dessous, obtenue lors du titrage, représente l’évolution de la conductivité σ du milieu
réactionnel en fonction du volume d’hydroxyde de sodium VB versé : s en mS·cm-1
.
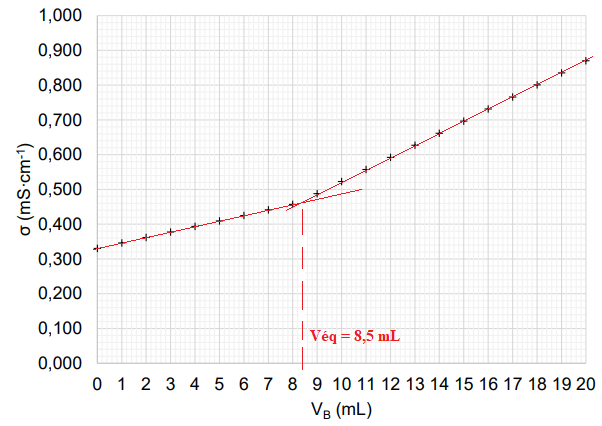
C.8. Interpréter qualitativement l’évolution de la pente de la courbe de titrage.
Avant l'équivalence HO- est en défaut. On ajoute des ion Na+ et il se forme des ions ascorbate. La conductivité croït.
Après l'équivalence, HO- est en excès et sa conductivité
molaire ionique est bien supérieure à celle des autres ions. La
conductivité de la solution augmente fortement.
C.9. Déterminer la concentration en quantité de matière d’acide ascorbique de la solution
titrée.
C.10. En déduire la valeur de la masse m d’acide ascorbique contenue dans un comprimé.
A l'équivalence : Véq CB = V C.
C = Véq CB / V = 8,5 x 2,00 10-2 / 40,0 =4,25 10-3 ~4,3 10-3 mol / L.
Soit 4,25 10-3 / 4 =1,06 10-3 mol dans 250 mL ( dans un comprimé).
Masse d'acide ascorbique 176 x 1,06 10-3 ~0,19 g = 190 mg.
On estime l’incertitude-type associée à cette mesure à u(m) = 0,01 g.
C.11. Écrire la masse trouvée à la question précédente avec un nombre adapté de chiffres
significatifs.
m = (0,19 ±0,01) g.
C.12. Comparer la valeur mesurée à la valeur de référence en calculant le rapport
| m - mréf | /
u(m)
et commenter.
(0,2 - 0,19) / 0,01 =1 %.
L'indication du fabricant est correcte.
|
|