Chimie, synthèse
peptidique,
concours Capes
2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
...
|
|
.
.
|
..
..
......
...
|
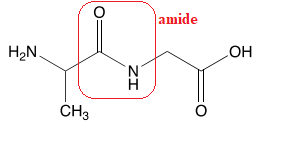
Synthèse du dipeptide alanine-glycine. Les
protéines sont des chaînes d’acides aminés qui peuvent entrer
dans la composition des muscles,
de la peau, des ongles, des poils, du sang, etc. La synthèse peptidique
est le processus consistant à faire
réagir différents acides aminés afin de former des polypeptides ou des
protéines. Dans la mesure où l’ordre d’enchaînement de ces acides
aminés est d’une importance cruciale, la synthèse peptidique nécessite
la
mise en œuvre d’une stratégie spécifique que l’on se propose
d’illustrer ici sur l’exemple de la synthèse d’un
dipeptide alanine-glycine dont la formule est donnée.
 Q9
Q9. Représenter les différents stéréoisomères de configuration de l’alanine. Préciser, en justifiant le
classement, les configurations absolues du(des) atomes(s) de carbone asymétrique(s) et indiquer
la(les) relation(s) d’isomérie qui les lient.
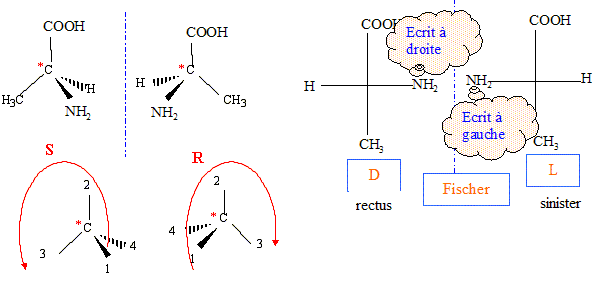
Ce sont deux énantiomères.
Q10. Identifier la fonction chimique créée lors de la formation du dipeptide.
Fonction amide.
Q11. Expliciter la (les) raison(s) pour laquelle ou lequelles on ne fait pas directement réagir l'alanine avec la
glycine.
On peut obtenir 4 dipeptides différents si on ne bloque pas certaines fonctions amine ou acide carboxylique.
Q12. Analyser le document 1 en explicitant le rôle de chacune des étapes en termes de stratégie de
synthèse.
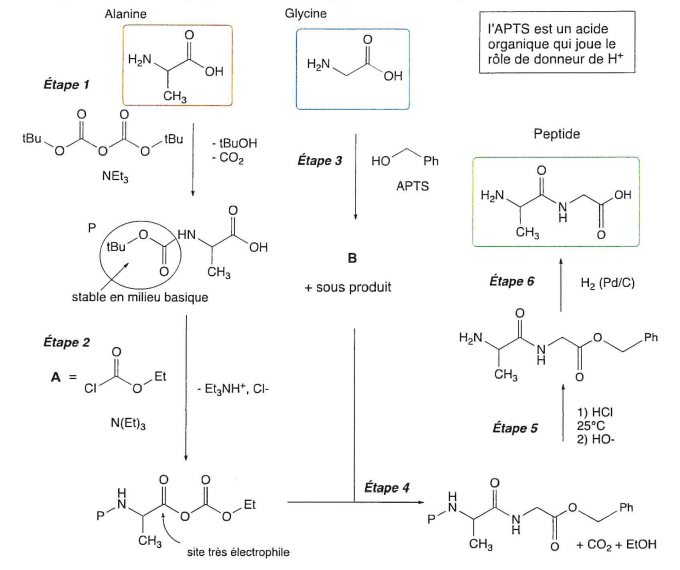
Etape 1 : on protège la fonction amine de l'alanine.
Etape 2 : le site électrophile de l'alanine est activé.
Etape 3 : on protège le groupe carboxyle de la glycine.
Etape 4 : création de la liaison peptidique.
Etape 5 : deprotection du groupe amine.
Etape 6 : déprotection du groupe carboxyle.
Q13. Donner le mécanisme de l’étape 2 en assimilant le réactif A à un chlorure d’acide.
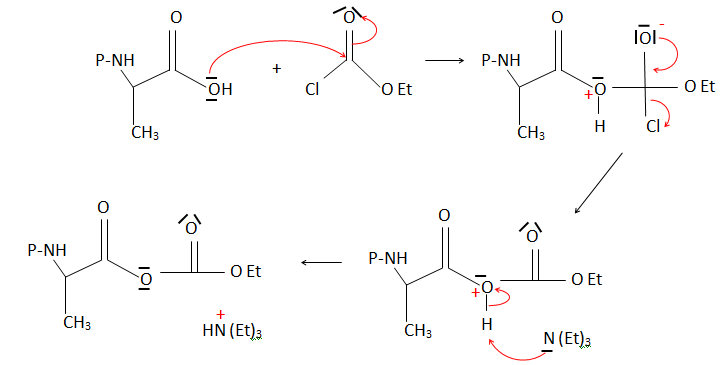 Q14.
Q14. Identifier le produit B de l’étape 3.
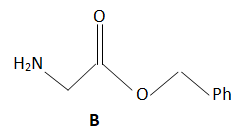
Le sous-produit est l'eau.
|
...
|
....
|
Apport calorique du dipeptide phénylalanine- acide aspartique.
Q15.
a) Écrire l’équation de la réaction qui modélise la combustion du dipeptide dans la bombe
calorimétrique, sachant qu’à l’issue de la combustion, l’élément azote se retrouve sous forme de
diazote gazeux et l’eau produite est à l’état liquide.
Volume d'eau : 2,0 L ; m = 2 g dipeptide C13H16O6(s) ; augmentation de la température 4,1 °C.
C13H16N2O6(s) + 14O2(g) --> 13CO2(g) +N2(g) +8H2O(l). (1).
b) À l’aide des données
thermodynamiques et des résultats expérimentaux présentés, évaluer le
pouvoir calorifique PC du dipeptide exprimé en kJ∙g-1
.
Energie libérée par cette combustion :
Q = meau ceau DT = 2 x4,18 103 x4,1 =3,4276 104 J.
PC = Q / m = 3,4276 104 / 2 =1,7138 104 J g-1 = 17,138 kJ g-1~17,1 kJ g-1.
c) Déduire de la question précédente l’enthalpie standard de combustion du dipeptide.
Hcomb = PC fois Masse molaire dipeptide = 17,138 103 x (12 x13 +16 +2 x 14 +6 x16) =17,1 103 x296 =5,07 106 J mol-1.
Les valeurs des apports caloriques des aliments protéinés indiqués sur les emballages diffèrent de celles
que l’on peut déterminer par calorimétrie. La raison en est que, lors de la combustion, l’azote contenu dans
les protéines conduit à la formation de diazote alors que lors de leur métabolisme, l’azote des aliments est
converti en urée (NH2)2C = O.
Q16. Modélisation de la métabolisation du dipeptide par l’organisme.
a) Écrire l’équation de la réaction qui modélise le métabolisme du dipeptide dans l’organisme.
C13H16N2O6(s) + 12,5 O2(g) --> 12CO2(g) +(NH2)2C = O(s) +6H2O(l). (2).
b) À l’aide des données thermodynamiques, déterminer la valeur du pouvoir calorifique PC du
dipeptide exprimé en kJ∙g-1
.
1,5 O2 (g) +(NH2)2C = O(s) -->CO2(g) +N2(g) +2H2O(l). (3).
DrH3= DfH(CO2(g))+ DfH((N2)g)+2DfH(H2O(l))- DfH(urée(s))-1,5 DfH(O2(g)).
DrH3= -393,5 +0+2(-285,8)-(-333,1)-15,*0 =-632 kJ / mol.
Or (2) = (1) +(3).
DrH2= 5,07 106 -6,32 105 =4,4 106 J / mol.
PC = DrH2 / M = 4,4 106 / 296 =1,5 104 J / g = 15 kJ / g.
Q17. Commenter l’étiquette d’un complément alimentaire riche en protéines.
L'étiquette indique 1640 kJ pour 100 g.
Soit 16,4 kJ / g, valeur proche de la valeur précédente.
|
|




