Chimie,
cinétique, thermochimie, pile, Concours TSPEI / 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
..
|
..
..
......
...
|
Exercice1 : les molécules.
1. Technique de
mesure.
On souhaite déterminer la masse volumique et la densité d’un composé
solide. On se propose
d’appliquer deux protocoles expérimentaux.
a. On pèse l’échantillon solide dans l’air puis on mesure un
volume d’eau qu’il déplace
lorsqu’il est immergé.
b. On pèse l’échantillon dans l’air puis dans l’eau, suspendu à
un fil.
Rappeler les définitions de masses volumique et densité.
Masse volumique ( kg m -3) = masse (kg) / volume ( m 3).
Densité par rapport à l'eau = masse d'un certain volume du solide /
masse du même volume d'eau.
Des deux protocoles a et b, lequel conduit à la détermination de
la densité du composé solide
et laquelle conduit à la détermination de la masse volumique ?
Justifier votre réponse.
Est-ce que la température a une influence sur la mesure de la masse
volumique ou la densité ?
Justifier votre réponse.
a: détermination de la massse volumique.
b. détermination de la densité.
A cause du phénomène de dilatation ( augmentation du volume sous
l'action de la température) la masse volumique dépend de la température.
Si la température augmente, les molécules du fluide s'écartent et la
densité diminue.
2. Calcul d’incertitude.
On rappelle que la composition molaire d’un mélange binaire est
définie par 𝑥 1 =
𝑛 1
/ (𝑛 1+𝑛 2
).
La préparation du mélange est effectuée par pesée. On désigne par m 1
et m 2 les masses des
composés 1 et 2. La précision de la balance est donnée par ±a.
Déterminez l’incertitude u(x 1) en fonction de la précision
de la balance.
u(x1)
=x1 [(u(m1) / m1)2+(u(m2)
/ m2)2 ]½.
3.
Structures moléculaires.
1. Soit l’oxygène 168
O
. Combien l’oxygène comporte-t-il d’électrons ? De neutrons ?
Donnez la structure électronique de cet élément et son schéma de Lewis.
8 électrons ; 8 protons et 16-8 = 8 neutrons.
Dans son état fondamental : 1s2 2s2 2p4.
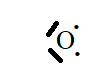
2. Soit
l’azote 14ZN. Combien l’azote comporte-t-il
d’électrons ? De neutrons ?
Donnez la structure électronique de cet élément et son schéma de Lewis.
7 protons, 7 électrons et 14-7 = 7 neutrons.
1s2 2s2 2p3.
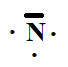
3.
Soit les molécules d’ammoniac et de dioxyde d’azote. Quelles sont leurs
structures ?
Justifier.
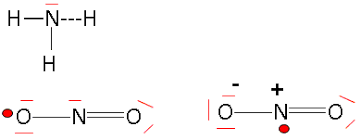 4.
4. Atomistique/pH.
L’ammoniac est un gaz à la température de 20°C et à la pression
atmosphérique (1.013 bar).
1. Quel est le volume
molaire ? On utilisera la loi des gaz parfaits.
PV = nRT ; V = nRT / P avec n = 1.
V = 8,31 x293 / (1,013 10 5) =0,024 m 3 /mol = 24,0
L /mol.
2. Quel volume
d’ammoniac gazeux (mesuré à 20°C et 1 atm) faut-il dissoudre dans 5
litres d’eau pour que le pH de la solution soit 10 ?
[H 3O +] = 10 -pH = 10 -10 mol
/L soit 5 10 -10 mol d'ion oxonium dans 5 L.
NH 4+ aq + H 2O(l) =NH 3aq + H3O+aq
Ka =[NH3aq]
[H3O+aq] / [
NH4+ aq]=(xf / V)2 / ((n-xf)
/ V) =xf 2 / ((n-xf)
V).
xf = [H3O+aq] V = 5 10-10
mol.
Ka = 25 10-20 / (5(n- 5 10-10)) =10-9,24
=5,75 10-10.
25 10-10 =5,75 ((5n- 25 10-10))
; 25 10-10 =28,75 (n - 5 10-10 );
n = 168,75 10-10 / 28,75 ~5,87 10-10 mol.
V = 24 n =1,4 10-8 L.
|
avancement
(mol)
|
NH4+
aq |
+ H2O(l) |
=NH3
aq |
+ H3O+aq |
initial
|
0
|
n
|
solvant
|
0
|
0
|
en
cours
|
x
|
n-x
|
x
|
x
|
final
|
xf
|
n-xf
|
xf |
xf |
3. Si on mélange 100 mL
de la solution ainsi obtenue et 50 mL d’une solution d’acide
chlorhydrique 1.35 10 -3 M, quel est le pH de la nouvelle
solution ?
Quantité de matière initiale : NH 3 :5 10-10 x 0,1 = 5 10 -11
mol.
H3O+aq :
1,35 10-3 x0,05 =6,75 10-5 mol ( large excès).
pH ~- log (6,75 10-5 /(0,1
+0,05)) ~3,3.
Données : Nombre d’Avogadro : 6.022×10 23 molécules dans une
mole.
Masse atomique de l’azote : 14 g/mol, masse atomique de
l’hydrogène : 1 g/mol
pKa du couple NH 4 +
/NH 3 : 9.24.
|
...
|
....
|
Exercice 2 – Diagramme des phases de
l'ammoniac.
On se propose d’étudier le diagramme de phase de l’ammoniac.
Les caractéristiques sont les suivantes :
Température critique : 405.56 K, Pression critique : 113.63 bar,
Température du point triple :
195.49 K, Température d’ébullition : 239.83 K.
Le tableau suivant donne des valeurs de pression de vapeur
saturante :
T(K)
|
400
|
380
|
370
|
350
|
302
|
298
|
293
|
273
|
263
|
253
|
243
|
233
|
223
|
210
|
200
|
P(MPa)
|
10,297
|
7,1397
|
5,8776
|
3,8652
|
1,1272
|
0,9981
|
0,8529
|
0,4269
|
0,2889
|
0,1888
|
0,1185
|
0,0711
|
0,0404
|
0,0177
|
0,0086
|
ln(P)
|
2,232
|
1,966
|
1,771
|
1,352
|
0,198
|
-1,9
10-3
|
-0,160
|
-0,85
|
-1,24
|
-1,67
|
-2,13
|
-2,64
|
-3,21
|
-4,03
|
-4,76
|
1/
T
|
0,0025
|
0,00263
|
0,00270
|
0,00286
|
0,0033
|
0,003356
|
0,00341
|
0,00366
|
0,00380
|
0,00395
|
0,00411
|
0,00429
|
0,00448
|
0,00476
|
0,005
|
A partir d’une loi type 𝑙𝑛(𝑃) = 𝐴 + B / T
, déterminer les paramètres A et B.
Quelle est la valeur de la pression à la température du point triple ?
La valeur de la pression à la température d’ébullition ?
A quelle grandeur thermodynamique peut-on associer le paramètre B ?
Justifier.
ln(P) = 9,467 -2820 / T.
Pression à la température d'ébullition : ln(P) = 9,467 -2820 / 239,83 =
-2,29 ; P =0,10 MPa.
B : enthalpie de cangement d'état.
2.Tracer le diagramme de
phases de l’ammoniac et identifier les domaines de
prédominance des phases solide, liquide, vapeur et supercritique.
Comment appelle t’on la
transition solide vers vapeur ?
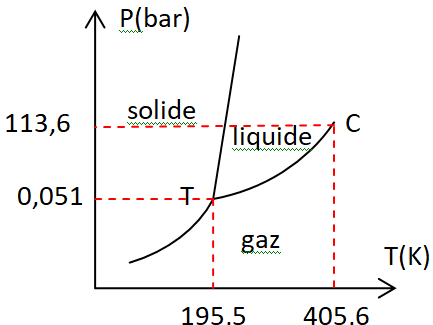
La
transition solide vers vapeur est appelée sublimation.
3. Cinétique chimique.
Soit la réaction chimique suivante :
CH3Br + OH- -->CH3OH+Br-
.
La loi de vitesse s’écrit v = k[CH3Br] [OH- ].
La constante de vitesse, à 298 K, vaut 2.8 10-4 L.mol-1.s-1.
On considère les trois cas de figure suivants :
a. [CH3Br]0=[OH- ]0= 8 10-2
mol / L
b. [CH3Br]0=[OH- ]0=
2 mol / L.
c. [CH3Br]0=0,08 mol / L ; [OH- ]0=
2 mol / L.
Pour chacun des cas, quelle est la vitesse initiale et quelle
proportion de CH3Br a-t-elle été
consommée après une heure de réaction ?
a : v0 =2,8 10-4 (8 10-2)2
=1,79 10-6 mol L-1 s-1.
-dc /dt = k c2.
dc / c2 =-kdt ; 1/c = kt + 1 / c0.
1 / c = 3600 x 2,8 10-4 +1 /0,08 = 13,5 ; c =0,074 mol / L.
b : v0 =2,8 10-4 (2)2 =9,6
10-4 mol L-1 s-1.
c : v0 =2,8 10-4 (8 10-2)*2=4,48 10-5
mol L-1 s-1.
Dégénerescence de l'ordre : on pose k' = k [OH- ]0=
2,8 10-4 x2 =5,6 10-4 s-1.
-dc/dt = k'c.
c = A exp(-k't).
c0 =A =0,08 mol /L ; c = 0,08 exp(-5,6 10-4t) ;
c(t= 3600 s) =1,06 10-2 mol / L.
Exercice 4. Le transport
de l’hydrogène.
Il est de plus en plus question d’utiliser l’hydrogène comme
vecteur énergétique. L’hydrogène
est une molécule haute inflammable dont la densité énergétique est
relativement faible à moins
de le liquéfier. Transporter et stocker l’hydrogène à l’état liquide
nécessite d’opérer à des
température cryogéniques (< 33 K).
Une autre solution consiste à « transformer » l’hydrogène en un composé
plus facilement
transportable. Plusieurs pistes sont envisagées et l’une d’entre elle
consiste à faire réagir
l’hydrogène avec l’azote pour former l’ammoniac. C’est une réaction
équilibrée. On se propose
d’examiner les conditions qui favoriseraient la production d’ammoniac
ou d’hydrogène.
La synthèse de l’ammoniac consiste en une réaction exothermique de
l'équation chimique à
l'équilibre :
N2(g) + 3 H2(g) =2 NH3(g) + ΔH.
1. Construire un tableau d’avancement sachant que l’azote et
l’hydrogène sont en
proportion stœchiométrique.
|
avancement
(mol)
|
N2(g)
|
+3 H2(g) |
=2NH3
g |
initial
|
0
|
n
|
3n
|
0
|
en
cours
|
x
|
n-x
|
3(n-x)
|
2x
|
final
|
xf
|
n-xf
|
3(n-xf)
|
2xf |
2. En déduire
l’expression de la constante d’équilibre en fonction du taux
d’avancement à
l’équilibre.
ntotal = 4 n -2x.
Pression partielle : PNH3 = x / (2 n -x ) P.
PH2 =3(n-x) / (4
n -2x) P
PN2 =(n-x) / (4 n -2x) P.
t = xf
/ n; K = PNH32 / [PH23PN2
].
3. Déterminer la valeur
de la constante d’équilibre Kp à 25°C.
DH° =2
DHf°(NH3)
-3 DHf°(H2)
- DHf°(N2)
= -2 x45,898 = -91,796 kJ / mol.
DS° =2
S°(NH3)
-3 S°(H2)
- S°(N2)
=2 x192,66 -3x130,571-191,609= -198 J K-1 mol-1.
DG° =DH° -TDS° = -91,796+298 x0,198 =
-32,79 kJ / mol.
ln K = -DG° / RT =
32,79 103 /(8,314 x298)=13,23 ; K =5,6 105.
4. En supposant que les
capacités calorifiques ne dépendent pas de la température,
déterminer l’expression de l’enthalpie de réaction en fonction de la
température. En
déduire l’expression de la constante d‘équilibre en fonction de la
température.
d ln K / dT = DH°
/(RT2).
d ln (K )= DH°
/(RT2)dT.
Ln K1 -ln K2 = -DH° / R (1/T1-1/T2).
ln K1 -13,23 = 91,796 103 /8,314 (1/ T -1 / 298).
ln K1 = 13,23-37,05 +1,104 104 / T = -23,82 +1,104
104 / T.
5. On souhaite convertir 90% de
l’azote, à quelle température doit-on opérer ?
Taux d'avancement à l'équilibre = 0,9.
xf = 0,9 n.
PNH3 = 0,9n / (2 n -0,9n ) P =0,9 /1,1P =0,818 P.
PH2 =3(n-0,9n) / (4
n -1,8n) P =0,136 P
PN2 =(n-0,9n) / (4
n -1,8n) P=0,0454 P.
K = PNH32 / [PH23PN2
] = 0,8182 / (0,0454 x0,1363P2)=5,86 103 / P2 = 5,86 103 si P = 1 bar.
ln K = -23,82 +1,104
104 / T.
ln(5,86 103) +23,82 =1,104
104 / T.
32,5 =1,104
104 / T ; T =338 K.
6. Proposer un mode
opératoire permettant de transporter l’hydrogène avant son
utilisation ?
Transport dans le réseau de gaz naturel avec 10 % d'hydrogène. ( on utilise l'infrastructure existante).
Exercice 4. Fonctionnement
d’une pile.
Une autre solution utilisée pour transporter de l’énergie et
d’utiliser une pile. On se propose ici
d’étudier une pile formée par l’association de deux couples redox Fe2+/Fe
et Cd2+/Cd.
1. Rappeler les
définitions d’un oxydant et d’un réducteur.
Oxydant : espèce susceptible de gagner un ou plusieurs électrons.
Réducteur : espèce susceptible de céder un ou plusieurs électrons.
2. Ecrire les demi-réactions redox pour les couples redox.
On rappelle que les potentiels standards sont pour le couple Fe2+/Fe
E0= -0.44 V et pour le
couple Cd2+/Cd E0= -0.40 V.
Le fer est plus réducteur que le cadmium.
Fe =Fe2++ 2e- .
E1 = -0,44 + 0,03 log[ Fe2+].
Cd2++ 2e- = Cd
E2 = -0,40 + 0,03 log[ Cd2+].
3. Rappeler le fonctionnement d’une pile. On réalisera un schéma
détaillé en indiquant les
électrodes positive et négative, la f.é.m., l’anode et la cathode.
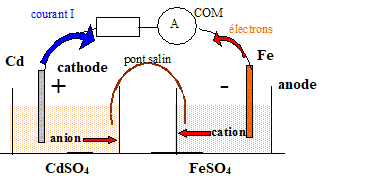
4. Quelle réaction chimique se produit quand la pile débite du courant ?
Fe
+Cd2+-->
Fe2++ Cd.
5. On considère une concentration en ions Fe2+ égale à
1 mol.l-1. Si on souhaite que la pile
fonctionne en « sens inverse », c'est-à-dire que le couple Fe2+/ Fe
devienne oxydant,
quelle doit être la concentration en ions Cd2+ ?
Fonctionnement en pile : E =E2-E1 =-0,40 +0,44 +0,03 log([ Cd2+] /[ Fe2+] ).
E = 0,04 +0,03 log([ Cd2+] )
Fonctionnement en récepteur : E < 0 soit 0,04+0,03 log([ Cd2+] ) < 0.
log([ Cd2+] ) < -0,04 / 0,03 ; log([ Cd2+] ) < -1,33 ; [ Cd2+] < 0,046 mol / L.
|
|