Chimie,
Concours interne ingénieurs de l'industrie et des mines
2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Combustion du méthane.
CH 4(g) + 2O 2(g) --> CO 2(g) +2H 2O(l) ; DHc = -890,82 kJ / mol.
Chaleur latente de changement de phase liquide-vapeur de l'eau à 298 K : DHvap = +44,87 kJ / mol.
1.
Citer le premier principe de la thermodynamique. Comment interpréter la
production d'énergie électrique par une centrale thermique
brûlant du gaz naturel ?
Enoncé du premier principe ( pour un système fermé ) ou pricipe de conservation de l'énergie :
Un système fermé évolue de l'état 1 à l'état 2 sous l'action des transferts mécanique Wext et thermique Q :
Le transfert mécanique Wext ne tient compte que des travaux des forces extérieures.
La
vapeur d'eau sous pression met en rotation le groupe turboalternateur.
Ce dernier convertit l'énergie mécanique en énergie électrique.
2. En utilisant la loi de Hess, quelle est l'enthalpie de la réaction de combustion suivante :
CH4(g) + 2O2(g) --> CO2(g) +2H2O(g).
CH4(g) + 2O2(g) --> CO2(g) +2H2O(l) ; DHc = -890,82 kJ / mol.
2H2O(l) --> 2H2O(g) : DHvap = +44,87 kJ / mol.
Ajouter : -890,82 +44,87 = -845,95 kJ / mol.
3.
Utilisant la réaction de combustion du méthane produisant de l'eau sous
forme de vapeur, quelle masse de méthane faut-il consommer pour
produire 1 MJ d'énergie ?
1 MJ = 106 J = 103 kJ ; 103 / 845,95 =1,18 mol.
M(méthane) = 12+4=16 g / mol.
1,18 x 16 =18,9 g.
4. Sachant
qu'une turbine à gaz industrielle fournit 100 MW, quelle est la masse
de gaz ( l'eau étant sous forme vapeur ) consommée par unité de temps
avec cette unité de production ? Donner cette valeur en quantité de
matière par unité de temps et en nombre de molécules par unité de
temps. Quelle est la masse de CO2 produite pour un fonctionnement de cette unité pendant 3 mois ?
100 MW = 100 MJ / s.
Masse de gaz : 18,9 x100 = 1890 g = 1,89 kg.
1890 / 16 = 118,2 mol / s.
118,2 x6,02 1023 =7,12 1025 molécules / s.
Quantité de matière de CO2 produite par seconde : 118,2 mol / s.
Masse : 118,2 x M(CO2) = 118,2 x44 =5,2 103 g / s = 5,2 kg /s.
3 mois = 90 x 24 x 3600 =7,8 106 s.
7,8 106 x 5,2 ~4,0 107 kg.
Structure du nickel.
1. Donnez la définition d'un alliage.
C'est la combinaison d'un élément métallique avec un ou plusieurs autres éléments chimiques.
2. Représenter la structure CFC du nickel.
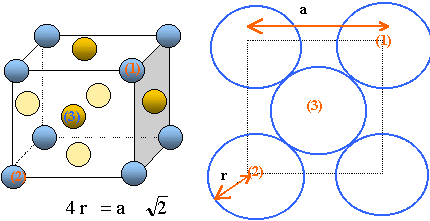 3. Donner le nombre d'atomes par maille.
3. Donner le nombre d'atomes par maille.
Chaque atome situé à un sommet appartient à 8 mailles et compte pour 1 /8.
Soit pour 8 sommets : 1 atome de nickel.
Chaque atome situé au centre d'une face appartient à 2 mailles et compte pour 0,5.
Il y a 6 faces soit 6 x0,5 = 3 atomes de nickel.
Total : 4 atomes par maille.
4. Indiquer la position dans la maille des sites interstitiels dans lesquels un atome pourrait se placer.
Site
tétraèdrique : les sommets du
tétraèdre sont constitués par un sommet du cube et trois atomes au
centre de trois faces ayant ce sommet en commun. Il y a huit sites tétraèdriques.
Site octaèdrique :
octaèdre. Il y en a 4 par maille; ils sont situés au centre de la
maille et aussi au milieu des arètes.
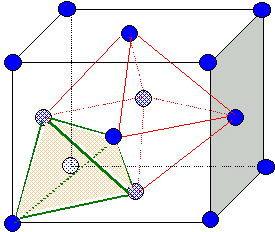 5. L'alliage de fer et de nickel est appelé ferronickel. Le rayon métallique du fer est rFe = 124,1 pm.
5. L'alliage de fer et de nickel est appelé ferronickel. Le rayon métallique du fer est rFe = 124,1 pm.
Indiquer si cet alliage est de substitution ou d'insertion. Justifier.
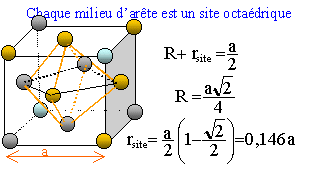
rsite = 0,146 *353 = 51,5 pm.
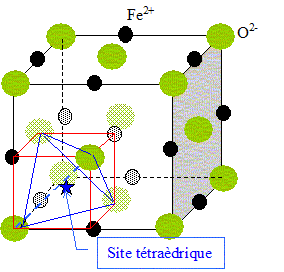
Dimension de la grande diagonale du petit carré rouge ( figure
ci-dessus) :
d2= (½a)2 + (½2½a)2 ; d = 3½
a/2 ;
RNi +Rtétra =½d =3½ a/4 ; Rtétra
=3½ a/4 - RNi = 1,732*353/4 -125 =27,8 pm.
rFe étant supérieur au rayon des sites, il s'agit d'un alliage de substitution.
Si les deux métaux ont des structures proches et des
rayons atomiques voisins, il se forme des alliages de substitution. C'est le cas du ferronickel.
Si l'un des atomes est beaucoup plus petit que l'autre,
alors le plus petit peut occuper des sites du réseau cristallin de l'autre atome
: il se forme des alliages d'insertion.
|
...
|
....
|
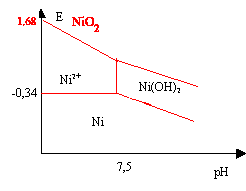
Diagramme potentiel-pH du nickel.
On limite le diagramme aux espèces suivantes : Ni ; Ni(OH)2 ; NiO2 et Ni2+. La concentration en espèces nickel est 0,001 mol / L.
1. Calculer le nombre d'oxydation du nickel danns chaque espèce.
Ni : nombre d'oxydation = 0.
Ni(OH)2 et Ni2+: nombre d'oxydation = + II.
NiO2 : nombre d'oxydation = +IV.
2. Calculer le pH de précipitation de Ni(OH)2. Ks(Ni(OH)2) = 10-16.
Ni2+aq + 2HO-aq = Ni(OH)2 s.
Ks = [Ni2+aq] [HO-aq]2 = 10-16.
[HO-aq]2 = 10-16 / 0,001 =10-13.
[HO-aq] =3,2 10-7 mol / L.
[H3O+aq] =10-14 / (3,2 10-7) =3,2 10-8 mol / L ; pH = -log(3,2 10-8) =7,5.
3. Quelles sont les frontières des couples électrochimiques. Etablir la réaction-bilan pour chaque réaction électrochimique.
4. Dans le domaine
de pH pour lequel un couple électrochimique prédomine, exprimer son
potentiel en fonction du pH et tracer le diagramme en indiquant dans
chaque domaine l'espèce prédominante.
Si pH < 7,5 : Ni(s) ---> Ni2+ aq + 2e-.
E = E°(Ni2+ aq / Ni(s) + 0,06 / 2 log [Ni2+aq] = -0,25 +0,03 log 0,001 = -0,34 V.
Si pH > 7,5 : Ni(s) +2HO-aq---> Ni(OH)2 s + 2e-.
E = E°(Ni(OH)2 s / Ni(s) + 0,06 / 2 log(1 / [HO-aq]2) = E°(Ni(OH)2 s / Ni(s) +0,03 log ( [H3O+aq] / 10-14)2).
E = E°(Ni(OH)2 s / Ni(s)+0,84 -0,06 pH.
A pH = 7,5 : E = -0,34 ;
-0,34 = E°(Ni(OH)2 s / Ni(s)+0,84 -0,06 x7,5 : E°(Ni(OH)2 s / Ni(s)=0,95 V.
Par suite : E = -0,11 -0,09 pH.
Si pH < 7,5 : NiO2 s + 4H+aq + 2e- --> Ni2+aq +2H2O(l).
E = E°(NiO2 s / Ni2+aq) + 0,06 / 2 log ((H+aq]4 / [Ni2+aq ]).
E = E°(NiO2 s / Ni2+aq) +0,09- 0,12 pH.
E°(NiO2 / Ni2+ )=1,59 V.
E = 1,68 -0,12 pH.
Si pH > 7,5 : NiO2 s + 2H+aq + 2e- --> Ni(OH)2 s.
E = E°(NiO2 s / Ni(OH)2 s) + 0,06 / 2 log (1 /(H+aq]2 ).
E = E°(NiO2 s / Ni(OH)2 s) - 0,06 pH.
A pH = 7,5 , E = 1,68 -0,12 x7,5 = 0,78 V.
E°(NiO2 s / Ni(OH)2 s)=0,78 +0,06 x7,5 =1,23 V.
E = 1,23 -0,06 pH.
|
|




