L'importance
de la vitamine C,
bac général Asie
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| .. |
.
.
|
|
.
.
|
..
..
......
...
|
L'acide ascorbique, communément appelé
vitamine C, est un antioxydant présent dans de nombreux
fruits et légumes.
La vitamine C est parfois utilisée dans des cosmétiques pour ses
propriétés antioxydantes. Elle est
aussi prescrite en complément alimentaire car elle joue un rôle
important dans le métabolisme de
l'être humain. Elle se dégrade à l'air, à la lumière et en présence
d'oxydants.
L'objectif de l'exercice est d'étudier la dégradation de la vitamine C
laissée à l'air libre dans un
comprimé (partie A) ou dans un jus de fruit (partie B), puis d'examiner
sa présence comme
antioxydant dans les cosmétiques (partie C).
Partie A - Dégradation de la vitamine C dans un comprimé.
La vitamine C est commercialisée sous forme de comprimés à croquer. Ces comprimés sont
conditionnés dans des tubes hermétiques et sous emballage protecteur. Cet emballage indique que
chaque comprimé contient 250 mg d'acide ascorbique.
Un comprimé de vitamine C a été laissé plusieurs jours à l'air libre. La vitamine C qu'il contient a
réagi avec le dioxygène de l'air.
On souhaite déterminer la masse d'acide ascorbique restant dans le comprimé d I'aide d'un titrage
avec suivi conductimétrique d'une réaction acido-basique.
Une solution aqueuse SA est préparée par dissolution complète d'un comprimé de vitamine C dans
l'eau. Le volume de la solution SA est V = 200,0 mL.
L'acide ascorbique et ses couples acide-base.
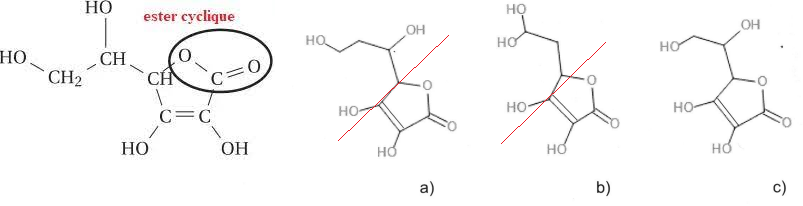
1. Parmi les trois propositions ci-dessous, indiquer celle qui correspond d la formule
topologique de la vitamine C.
Préparation de Ia solution titrante.
Au laboratoire, on dispose d'une solution aqueuse drhydroxyde de sodium de concentration
C0 = 0,200 mol / L.
2. Déterminer le volume V0 de solution d'hydroxyde de sodium de concentration C0 à prélever
afin d'obtenir un volume VB = 200,0 mL de solution d'hydroxyde de sodium de concentration CB=1,00 10-2 mol / L.
3. Préciser la verrerie nécessaire pour mesurer V0 et VB.
Facteur de dilution : 0,20 / (1,00 10-2)=20.
Volume à préléver à l'aide d'une pipette jaugée : 200 / 20 = 10,0 mL
Fiole jaugée de 200,0 mL.
Titrage de la solution SA.
On prélève un volume VA = 20,0 mL de la solution aqueuse SA que l'on titre par une solution aqueuse
d'hydroxyde de sodium (Na+, HO-) de concentration CB = 1,00x10-2 mol / L.
Les couples acide-base mis en jeu sont AH2/AH- pour l'acide ascorbique et H2O/HO-.
Le titrage acido-basique des 20,0 mL de solution SA par la solution d'hydroryde de sodium de
concentration CB = 1,00x10-2 mol / L est réalisé. La conductivité de la solution est relevée en fonction
du volume d'hydroxyde de sodium versé. La courbe de titrage est tracée figure ci-après.
4. Ecrire l'équation de la réaction support du titrage avec les notations simplifiées et
justifier qu'il s'agit d'une transformation acide-base au sens de Bronsted.
AH2 aq + HO- aq--> AH-aq + H2O (l).
Transfert d'un proton de l'acide AH2 vers la base HO-.
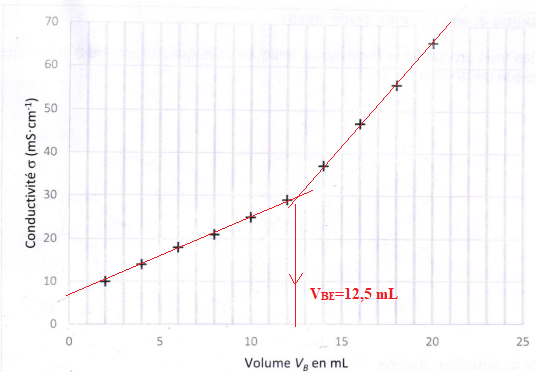
5. Justifier le changement de pente observé sur le graphique, en s'appuyant sur les
conductivités molaires ioniques.
Avant l'équivalence : HO- est en défaut. On ajoute des ion Na+ et il se forme l'ion AH-, la conductivité de la solution augmente.
Après l'équivalence : HO-
est en excès. On ajoute des ions sodium et des ion hydroxyde de
conductivité molaire ionique importante, la conductivité de la solution
croît plus rapidement.
6. Déterminer le volume à l'équivalence.
7. En déduire la valeur de la masse m de vitamine C dans le comprimé resté d l'air libre et
vérifier que cette valeur est comprise entre190 mg et 230 mg.
n(AH2) = CB VBE =1,00 10-2 x 12,5 = 0,125 mmol dans 20 mL soit 1,25 mmol dans 200 mL ou un comprimé.
1,25 x M(vitamine C) = 1,25 x176,1 =220 mg.
8. Justifier, à partir de l'information fournie par I'emballage au sujet de chaque comprimé,
qu'une réaction de la vitamine C a bien eu lieu.
(250-220) / 250 =0,12 ( 12 % de la vitamine C s'est dégradée ).
|
...
|
....
|
Partie B - Etude cinétique de la dégradation de la vitamine C dans un jus d'orange.
La vitamine C est la plus fragile de toutes les vitamines : elle
se dégrade rapidement à la chaleur, à l'eau, à I'air et à la lumière.
Par exemple, à température ambiante, la moitié de la teneur en vitamine
C d'un jus de fruit peut être perdue en 24 heures.
En conséquence, les modes de stockage doivent être adaptés de manière à
limiter les pertes : les
industriels conservent les produits à basse temp6rature (inférieure a
5°C) en y adjoignant des
agents actifs. >
D'après /'AFSSA - Agence Frangaise de Securite Sanitaire des Aliments .
On dispose d'un jus d'orange filtré à la température T1 = 25°C. A partir de données exp6rimentales,
on a modélisé le suivi cinétique de la dégradation de la vitamine C, ou acide ascorbique, dans ce jus
d'orange et à cette température.
Données
- L'acide ascorbique est aussi un réducteur et fait partie du couple C6H6O6 aq / C6H8O6 aq.
- Le dioxyène est I'oxydant du couple O2(g) / H2O(l).
9. Ecrire les demi-équations correspondant aux couples mis en jeu lors de la dégradation de
la vitamine C par le dioxygène de l'air et montrer que l'équation de l'oxydation de la vitamine
C s'écrit :
2C6H8O6 aq +O2(g) --> 2C6H6O6 aq +2 H2O(l)
O2(g) +4H+aq +4e- -->2 H2O(l).
2 fois { C6H8O6 aq --> C6H6O6 aq +2H+aq + 2e- }
Ajouter : 2C6H8O6 aq +O2(g) +4H+aq +4e- --> 2C6H6O6 aq +4H+aq + 4e- +2 H2O(l).
Simplifier : 2C6H8O6 aq +O2(g) --> 2C6H6O6 aq +2 H2O(l)
10. Définir la vitesse volumique de disparition de la vitamine C.
v = - d[C6H8O6] / dt.
11.A partir du graphique de la figure, décrire qualitativement l'évolution de la vitesse de
disparition de la vitamine C en fonction du temps, à une température donnée, et faire le lien
avec un facteur cinétique à préciser.
La vitesse de disparition de la vitamine C est égale à la valeur
absolue de la pente des tangentes à la courbe ci-dessus. Or celles-ci
sont de moins en moins inclinées par rapport à l'horizontale. La
vitesse de disparition diminue au cours du temps.
Au cours du temps la concentration en vitamine C diminue ; la concentration étant un facteur cinétique, la vitesse diminue.
12. Déterminer graphiquement la vitesse volumique de disparition de la vitamine C d la
température T1 = 25 °C d la date t1 = 60 h. L'exprimer en mmol.L-1h-1.
13. Déterminer graphiquement le temps t½ de demi-réaction à la température T1 = 25°C et vérifier
que cette valeur est cohérente avec celle annoncée dans le texte introductif de la partie B.
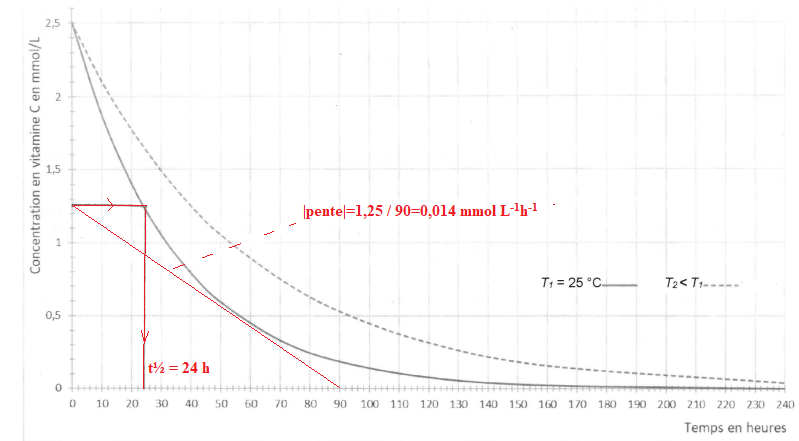
14. A partir de la figure , en comparant les deux courbes, donner un deuxième facteur
cinétique, et indiquer pourquoi il est préférable de ne pas laisser le jus d'orange sur la table
du petit déjeuner.
La température est un facteur cinétique : conserver le jus à basse température.
Partie C - Vitamine C dans les crèmes.
Une crème hydratante est une émulsion constituée d'une phase hydrophobe (comme de I'huile) et
d'une phase aqueuse (comme de l'eau). La phase aqueuse apporte de l'eau à la peau. La phase
huileuse nourrit la peau et forme une couche grasse qui empèche l'eau de s'évaporer.
Divers additifs peuvent participer à la composition d'une crème :
- la vitamine C, qui est un antioxydant ;
- le glycérol, qui est une substance hydratante ;
- la paraffine, un filtre solaire, etc.
Lorsque la vitamine C entre dans la composition d'une crème, certaines recommandations sont
indiquées, comme, par exemple, celles reproduites dans l'encadré ci-dessous.
- Recommandation n° 1 : ne pas combiner la vitamine C avec d'autres produits contenant
des ions cuivre Cu2+. Cela peut entrainer un changement de couleur de la crème qui peut se
traduire par I'apparition de taches colorées sur la peau.
D'apres : www. cosmopolitan.fr
- Recommandation n°2: pour qu'une crème ou sérum à la vitamine C soit efficace, il faut
que la vitamine C soit présente majoritairement sous forme d'acide ascorbique. ll est alors
indispensable que le cosmétique contenant de la vitamine C ait un pH acide inférieur ou égal à
3,5.
D,apres:wv,M.medecine-anti_aqe.com.
Données:
- Couples rédox mis en jeu : C6H6O6 aq / C6H8O6 aq.
et Cu2+ / Cu.
- Le cuivre solide est de couleur rouge orange.
L'6quation de l'oxydation de la vitamine C par I'ion Cu2+ s'écrit :
C6H8O6 aq + Cu2+aq --> C6H6O6 aq + Cu(s) + 2H+aq.
15. Justifier le fait que des taches colorées peuvent apparaitre, comme indiqué dans la
recommandation n°1 .
La vitamine C réduit l'ion cuivre (II) en cuivre métallique de couleur rouge.
16. Etablir le diagramme de prédominance pour les couples AH2/AH- et AH- /A2-.
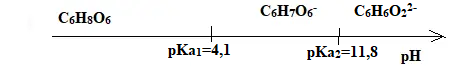
17. Evaluer la valeur du rapport [AH2] / [AH- ] pour la valeur de pH indiquée et
justifier la recommandation n" 2 portant sur une valeur de pH à ne pas dépasser.
pH = pKa1 + log ( [AH2] / [AH- ] )
log ( [AH2] / [AH- ] ) =pH - pKa1 =3,5 -4,1 = -0,6.
[AH2] / [AH- ]= 10-0,6 =0,25.
A pH > 3,5 la vitamine C, note AH2 se dégrade rapidement en AH- , moins efficace.
|
|