Les produits ménagers commerciaux sont une source importante de déchets qu’on cherche à
réduire.
Dans cet exercice, on s’intéresse à la fabrication d’un assouplissant « fait maison » à partir de
vinaigre commercial et de bicarbonate de soude.
A. Vinaigre commercial
Un vinaigre commercial à 8 % est une solution aqueuse d’acide éthanoïque de formule CH
3COOH
contenant 8 g d’acide éthanoïque pour 100 g de solution. Pour vérifier la valeur de ce pourcentage,
appelé pourcentage massique, on réalise un dosage par titrage à l’aide d’un suivi pH-métrique. La
solution commerciale est diluée 10 fois. On obtient une solution notée S dont on prélève 10,0 mL
que l’on titre par une solution aqueuse d’hydroxyde de sodium de concentration C
B égale à
0,10 mol·L
-1
.
Q.1. Indiquer la verrerie nécessaire pour préparer 50,0 mL de solution S par dilution du vinaigre
commercial.
Fiole jaugée de 50,0 mL et pipette jaugée de 50,0 / 10 = 5,0 mL.
Q.2. Écrire l’équation de la réaction support du titrage entre l’ion hydroxyde et l’acide
éthanoïque.
CH
3COOHaq + HO
-aq --> CH
3COO
-aq + H
2O(l).
Q.3. À l’aide de la figure, montrer que la concentration C
com en quantité de matière d’acide
éthanoïque apportée dans le vinaigre commercial est égale à 1,4 mol·L
-1
.
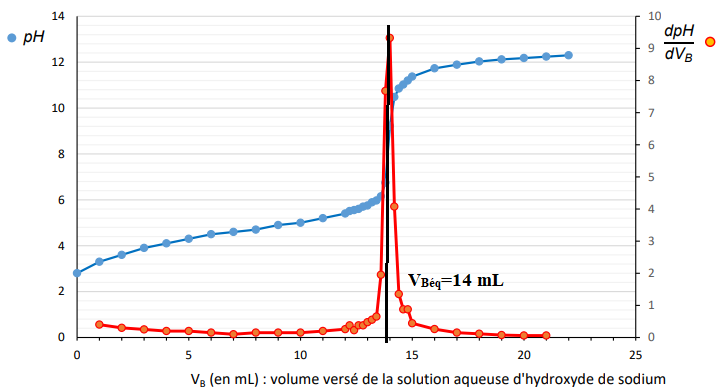
A l'équivalence : C
B V
Béqui = C V ; C =0,10 x14 / 10 = 0,14 mol/ L.
Tenir compte de la dilution : 0,14 x10 = 1,4 mol / L.
Q.4. En déduire le pourcentage massique en acide éthanoïque obtenu expérimentalement et le
comparer à la valeur annoncée par le fabricant, sachant que l’incertitude-type du titrage sur
le pourcentage massique vaut u(%) = 0,2 %.
M(CH3COOH) =60 g /mol ; concentration massique : 1,4 x 60 =84 g / L.
Masse de 1 L de vinaigre : m = 1,01 kg = 1010 g.
84 g d'acide éthanoïque dans 1010 g de vinaigre ou 84 x100 / 1010 = 8,3 g d'acide éthanoïque dans 100 g de vinaigre.
(8,3 %).
|uréf -uexp| /u(%)=(8,3-8) / 0,2 =1,5 < 2. Donc accord des valeurs.
On souhaite revenir maintenant à l’étude de la solution S de départ de concentration en quantité de
matière notée C
S. On va déterminer le pH de cette solution S.
L’équation de la réaction modélisant la transformation entre l’acide éthanoïque et l’eau est :
CH
3COOH(aq) + H
2O(l) = CH
3COO
-
(aq) + H
3O
+
(aq)
.
Q.5. En utilisant éventuellement un tableau d’avancement, montrer qu’à l’équilibre la constante
d’acidité du couple CH
3COOH(aq)/ CH
3COO
-
(aq) peut s’exprimer de la manière suivante :
relation 1 : Ka =
[H
3O
+
]
éq
2
/ (C
S
- [
H3O
+
]
éq) × c°
) avec c° = 1 mol·L
-1
.
La relation 1 peut aussi s’écrire :
[H3O
+
]
éq
2
+ Ka × c° ×[H3O
+
]
éq
- Ka × CS × c° = 0
.
Ka =
[H3O
+
]
éq [CH3COO- ]
éq / [CH3COOH]éq.
La solution est électriquement neutre et HO- négligeable en solution acide.
[H3O
+
]
éq =[CH3COO- ]
éq ;
Conservation de l'élément carbone : CS = [CH3COO- ]
éq + [CH3COOH]éq.
Par suite : Ka =
[H3O
+
]
éq
2
/ (CS
- [H3O
+
]
éq) × c°
).
Q.6. En déduire la valeur du pH de la solution diluée S et montrer qu’elle est cohérente avec
celle lue sur la courbe de titrage.
On pose
[H3O
+
]
éq = x
[H3O
+
]
éq
2
+ Ka × c° ×[H3O
+
]
éq
- Ka × CS × c° = 0
. pKa = 4,8 ; Ka = 10-4,8 =1,58 10-5.
x2 +1,58 10-5 x-1,58 10-5 *0,14=0.
x2 +1,58 10-5 x-2,22 10-6 =0.
Discriminant : (1,58 10-5)2 +4 x2,22 10-6 =8,88 10-6 ;
x =(-1,58 10-5 +2,98 10-3) / 2 =1,48 10-3.
pH = - log(1,48 10-3) =2,8. Valeur en accord avec le pH initial lue sur le graphique.