Exercice 1. 5
points
Lors d’une séance expérimentale, un binôme d’élèves réalise la vidéo du
mouvement d’une
voiture miniature de masse m = 0,040 kg, en roue libre. L’objectif de
l’expérience est de
déterminer l’intensité F de l’ensemble des forces de frottement qui
s’exercent sur la voiture
et la distance d parcourue avant l’arrêt. Les forces de frottement sont
supposées
constantes. L’étude est menée dans le référentiel du sol supposé
galiléen. Le mouvement
de la voiture est rectiligne et s’effectue selon un axe horizontal (Ox)
fixe.
L’analyse de la vidéo obtenue par le binôme d’élèves, au moyen d'un
logiciel de pointage,
permet d'obtenir le graphe de l’évolution de la position x du centre de
masse G de la voiture
au cours du temps.
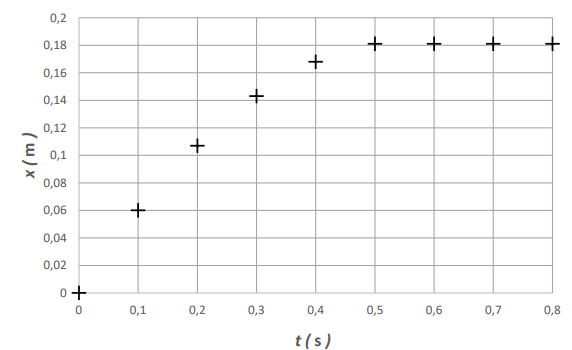 1.
1. Décrire
l’évolution (croissante,
décroissante…) de la vitesse de la voiture au cours du temps.
Les distances parcourues pendant des durées constantes diminuent au
cours du temps : la vitesse décroît.
2. En
utilisant la figure, calculer la vitesse moyenne de la voiture entre
les instants t
0 = 0
et t = 0,1 s.
0,06 / 0,1 = 0,6 m /s.
Le nuage expérimental de points peut être modélisé par une fonction
polynomiale sur
l'intervalle de temps [0 ; 0,50], le temps étant exprimé en secondes.
On rappelle que la
position x est exprimée en mètres.
Cette fonction, notée x, a pour expression : x(t) = −0,58 ×t
2
+ 0,65 × t.
La fonction x est dérivable sur l’ensemble des réels. On note x′
sa dérivée.
3. Déterminer x′(t) pour
tout réel t.
x'(t) = -0,58 *2t +0,65 = -1,16t+0,65.
4. Calculer x′(0).
x'(0) = 0,65 m/s.
5. Nommer la
grandeur physique à laquelle fait référence x′(0).
La vitesse initiale.
6. Déduire de la
question 3 la valeur de l’accélération définie sur l’intervalle de
temps [0 ; 0,50], le temps étant exprimé en secondes. Interpréter le
signe dans la
situation étudiée.
x"(t) = -1,16 m s
-2. La voiture décelère.
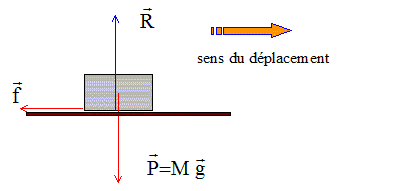
7. Réaliser le
bilan des forces modélisant les actions mécaniques s’exerçant sur la
voiture
au cours de son mouvement. Les représenter sans souci d’échelle sur un
schéma où la
voiture est réduite à son centre de masse G.
Poids, verticale, vers le bas, valeur mg.
Action normale du plan, opposée au poids ;
Force de frottement, sens contraire du mouvement..
 8.
8. En utilisant la
seconde loi de Newton, montrer que l’intensité f de l’ensemble des
forces
de frottement s’exerçant sur le système voiture s’écrit : f = −m x a.
Ecrire la seconde loi de Newton sur un axe horizontal orienté dans le
sens du mouvement : f = -m a.
9. Montrer que la
valeur numérique de l’intensité 𝐹 de l’ensemble des forces de
frottements
est égale à 4,6 × 10
−2 N.
m = 0,040 kg ; a = -1,16 m s
-2 ; f = 0,040 x1,16 =
4,6 × 10−2 N.
On rappelle que la voiture parcourt une distance d avant de s’arrêter
et que le travail de la
force constante f entre le point de départ O et le point d’arrêt A
s’écrit
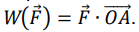
.
10. Montrer que
W(f) = −f x d.
W = f x d x cos 180 = - f x d.
La variation de l'énergie cinétique du système voiture entre les
instants t
0 = 0 et t
f = 0,5 s
(instant à partir duquel on considère la vitesse nulle) est égale au
travail de l’ensemble des
forces de frottements.
11.En déduire la
valeur de la distance d parcourue par la voiture entre les instants t
0
et t
f.
Confronter le résultat obtenu à celui que l’on peut déterminer sur la
figure 1.
Théorème de l'énergie cinétique : 0-½mv
2= -f d.
d = ½mv
2 / f =0,5 x 0,040 x0,65
2 / 0,046=0,18 m.
En accord avec la figure.
Exercice 2. 5
points.
La mobilité décarbonée est un défi à relever afin de limiter la
pollution engendrée par les
modes de transport classiques. Une solution proposée est celle de
véhicules électriques
utilisant une pile à hydrogène qui nécessite du dihydrogène pour
fonctionner.
On s’intéresse à la production du dihydrogène par l’électrolyse de
l’eau acidifiée par la
présence d’acide sulfurique (2H
+,SO
4 2−) dans un électrolyseur de
laboratoire de
lycée. Lors
de cette transformation chimique, l’eau se décompose et il se forme du
dihydrogène et du
dioxygène. Dans la littérature, les rendements indiqués dans le cas de
l’électrolyse
industrielle de l’eau sont compris entre 75 et 90 %.
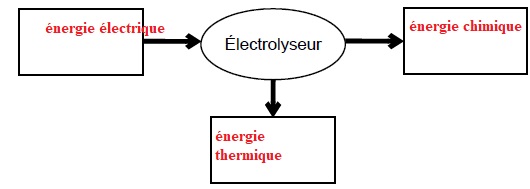
Un électrolyseur est un dipôle qui convertit une partie de l’énergie
électrique reçue en
énergie chimique. Au laboratoire, on dispose de l’électrolyseur
dont la caractéristique tension-intensité est donnée ci-dessous.
Données :
- Énergie chimique nécessaire à la formation d’un volume égal à 1,0 mL
de
dihydrogène, à la pression atmosphérique, lors de l’électrolyse de
l’eau réalisée
au laboratoire : 11 J.
- Couples oxydant/réducteur mis en jeu lors de l’électrolyse : H
+(aq)/H
2(g)
et
O
2(g)/H
2O(l).
1. Indiquer, en
expliquant la réponse, si l’électrolyseur est un générateur ou un
récepteur
électrique. Schématiser la conversion énergétique qui a lieu dans
l’électrolyseur en
faisant apparaître les différentes formes d’énergie mises en jeu.
Un électrolyseur est un récepteur : il reçoit de l'énergie électrique
qu'il convertit en énergie chimique et en énergie thermique.
 2.
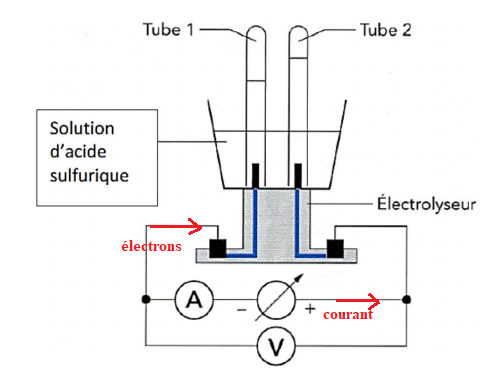
2. Compléter le
schéma du montage d’électrolyse en indiquant le sens de circulation du
courant et
celui des électrons dans le circuit.
 3.
3. Écrire
l’équation de la réaction modélisant la transformation se produisant au
niveau de
l’électrode reliée à la borne négative du générateur (à cette
électrode, le dégagement
gazeux se produit dans le tube 1).
4. Préciser, en expliquant la
réponse, si cette électrode constitue l’anode ou la cathode du
dispositif.
Réduction à la cathode : 2H
+aq + 2e
- --> H
2(g).
5. Écrire l’équation de
la réaction modélisant la transformation se déroulant lors de
l’électrolyse de l’eau.
H
2O(l) --> H
2(g) + ½O
2(g).
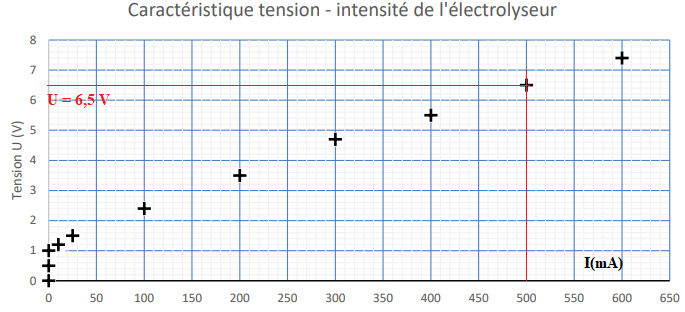
6. Déterminer la valeur
de la tension mesurée aux bornes de l’électrolyseur du laboratoire
lorsqu’il est traversé par un courant électrique d’intensité égale à
500 mA.
U = 6,5 V.
7. En déduire
la valeur de la puissance électrique reçue par l’électrolyseur en
fonctionnement dans ces conditions.
P = U I = 6,5 x0,5 = 3,25 ~3,3 W.
On réalise au laboratoire l’électrolyse de l’eau pendant une
durée de deux minutes avec
une intensité du courant maintenue égale à 500 mA. Il se forme alors un
volume de
dihydrogène égal à 20 mL.
8. Montrer que la
valeur de l’énergie électrique reçue par l’électrolyseur pendant les
deux
minutes de fonctionnement est environ égale à 400 J.
Energie E = U I t = P t = 3,25 x2 x60 =3,9 10
2 J.
9. Déterminer le
rendement de l’électrolyseur en fonctionnement. Commenter ce résultat
par rapport à une électrolyse industrielle.
Données :
- Énergie chimique nécessaire à la formation d’un volume égal à 1,0 mL
de
dihydrogène, à la pression atmosphérique, lors de l’électrolyse de
l’eau réalisée
au laboratoire : 11 J.
Energie chimique : 11 x20 = 220 J.
Rendement = énergie chimique / énergie électrique = 220 / 390 =0,56 (
56 %), inférieure au rendement industriel.