Chimie,
concours
adjoint technique principal Versailles
2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Chimie.
L’éosine est un colorant rouge solide de masse molaire M = 691,9 g.mol-1.
Un professeur prépare une activité expérimentale sur la décoloration de
l’éosine par l’eau de Javel et envisage un suivi de cette cinétique par
spectrophotométrie.
Q1 - La
concentration en masse de la solution aqueuse de colorant à utiliser
par les élèves est 2,8.10-3 g.L-1. Calculer la
masse d’éosine nécessaire à la préparation d’un litre de cette solution
par dissolution.
m = 2,8 10-3 g = 2,8 mg.
Q2 - Le laboratoire
dispose de balances de pesée, dont les précisions vont de 0,1 g près à
0,001 g près. Expliquer pourquoi la solution demandée ne peut pas être
préparée par une unique dissolution.
La balance la plus précise est à 1 mg près, donc impossible de peser
avec précision 2,8 mg.
Q3 - Une stratégie
de préparation d’un litre de solution aqueuse d’éosine à 2,8.10-3
g.L-1 consiste en une dissolution suivie d’une dilution.
Lister précisément le matériel nécessaire à l’ensemble de cette
préparation.
Balance de précision + coupelle + spatule.
Becher, fioles jaugées, pipette jaugée.
Q4 - La séance
d’activité expérimentale est programmée pour 3 groupes de spécialité de
terminale composés chacun de 20 élèves regroupés en binômes. Le
professeur a indiqué une quantité nécessaire et suffisante de 50 mL de
solution d’éosine par paillasse. Déterminer si la préparation d’un
litre de solution est suffisante pour l’ensemble des terminales du
lycée.
60 élèves soit 30 binômes soit 30 x50 = 1500 mL = 1,5 L. ( donc 1 L est
insuffisant).
Q5 - Parmi les
appareils représentés ci-dessous, choisir celui correspondant à un
spectrophotomètre.

Q6 - Déterminer en
justifiant la couleur de la solution préparée.
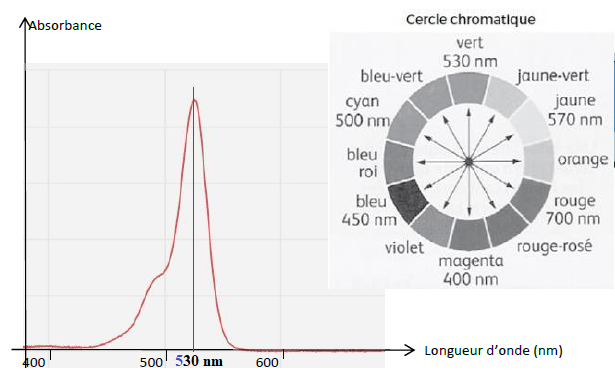
Le maximum d'absorption se situe vers 530 nm ( vert). La solution est
magenta, couleur complémentaire du vert.
Q7 - Préciser le
solvant à prévoir pour faire le blanc de l’appareil et justifier le
fait que des cuves en plastique soient adaptées pour la séance.
Solution aqueuse d'éosine :
le solvant est l'eau pour faire le blanc.
La gamme de transmission des cuves en plastique s'étend de 380 à 780 nm
( spectre visible).
Q8 - Indiquer dans
quel cas il est préconisé d’utiliser des cuves en verre.
Verre optique : plage de transmission 340 à2500 nm.
Quartz IR : plage de transmission 220 à 3500 nm. C'est un bon choix
pour les mesures UV VIS.
L’eau de Javel est une solution aqueuse incolore d’hypochlorite de
sodium (Na+(aq), CℓO-(aq)) et de chlorure de
sodium (Na+(aq), Cℓ-(aq)). Un berlingot
commercial étiqueté à 4,8 % de chlore actif correspond à une solution
de concentration en hypochlorite [CℓO-]0 = 0,72
mol.L-1. La concentration de la solution à préparer pour les
élèves est de 0,48 mol.L-1.
Q9 - Indiquer la
position de la colonne de l’élément chimique chlore Cℓ dans la
classification périodique.
Colonne des halogènes ( numéro 17 ).
Q10 - Calculer le
facteur de dilution à appliquer pour la préparation de la solution
d’eau de Javel à partir du berlingot commercial.
0,72 / 0,48 =1,5.
Au laboratoire, vous retrouvez un flacon noté « eau de Javel diluée »
sans autre précision, et vous souhaitez déterminer sa concentration par
titrage pour savoir s’il est possible de l’utiliser. Cela se fait en
deux étapes :
Etape 1 : réaction
avec les ions iodures
Les ions hypochlorite ClO-(aq) oxydent les ions iodures I-(aq) en
milieu faiblement acide. Les ions I-(aq) sont ajoutés en excès pour que
tous les ions ClO-(aq) réagissent.
ClO-(aq) + 2 H+(aq) + 2 I-(aq) = Cl-(aq)
+ I2(aq) + H2O (1)
Etape 2 : réaction
de titrage du diiode obtenu
Le diiode I2(aq) formé est titré par les ions thiosulfate S2O32-(aq).
I2(aq) + 2 S2O32-(aq) =2 I-(aq)
+ S4O62-(aq) (2)
Q11 - Ecrire tous
les couples d’oxydo-réduction mis en jeu dans les réactions (1) et (2)
en précisant le rôle (oxydant ou réducteur) des espèces réactives
utilisées.
Etape 1 : oxydant ClO-(aq) / Cl-(aq) et
réducteur I-(aq) / I2(aq).
Etape 2 : S4O62-(aq) / S2O32-(aq)
réducteur et I-(aq) / I2(aq) oxydant.
Lors de l’étape (2), la
solution titrante de thiosulfate de sodium (2 Na+(aq) ; S2O32-(aq))
utilisée a pour concentration C2 = 0,200 mol.L-1.
Juste avant l’équivalence, le mélange devient jaune clair, et on y
ajoute quelques gouttes d’une solution d’empois d’amidon. Le volume
relevé à l'équivalence est VE = 14,4 mL.
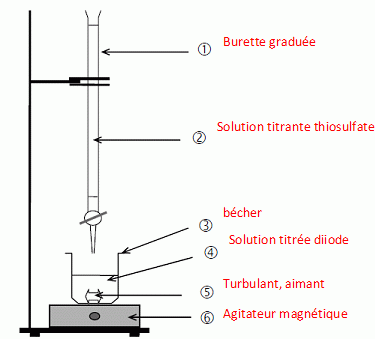
Q12 - Légender le
schéma de ce titrage.
Q13 - Indiquer le
rôle de l’empois d’amidon.
Indicateur coloré de fin de réaction.
En
présence de diiode , l'empois d'amidon forme un complexe de couleur
violet foncé ( couleur de la solution avant l'équivalence) ; après
l'équivalence, toutes les espèces sont incolores.
Q14 - Sachant que
la relation à l’équivalence entre les quantités de matière des réactifs
mis en jeu s’écrit n(S2O32-(aq)) = 2 n(I2(aq)),
déterminer la quantité initiale de diiode de l’étape 2.
n(I2(aq)) = ½ VE C2 =
0,5 x14,4 x0,200 =1,44 mmol.
Q15 - En déduire la quantité n(CℓO-)
d’ions hypochlorite dans le volume V1 = 20,0 mL prélevé de
la solution d’eau de Javel, puis la concentration [CℓO- ]1
de la solution du flacon trouvé au laboratoire. Conclure si elle peut
être utilisée pour la préparation de l’activité expérimentale.
n(CℓO-)=n(I2(aq))
=1,44 mmol dans 20,0 mL soit 1,44 / 20,0 =0,072 mol / L, inutilisable,
trop diluée.
Q16 - Plusieurs
panneaux de signalétique liés à la sécurité sont présents dans la salle
de travaux pratiques. En choisir deux indiquant la présence d’un
dispositif pouvant être utilisé suite à une projection accidentelle
d’eau de Javel dans les yeux d’un élève.

Q17 - Donner la
signification du sigle FDS.
Fiche de données et de sécurité.
Q18 - Expliquer la
signification des pictogrammes de danger indiqués.

Q19 - Indiquer la
formule chimique et le nom exact du gaz toxique dégagé par réaction
entre un acide et l’eau de Javel.
Dichlore Cl2.
Q20 - Parmi les
bidons de récupération suivants disponibles au laboratoire, choisir
celui dans lequel verser les déchets d’eau de Javel :
Solutions basiques.
|
...
|
....
|
B - Synthèse du paracétamol.
Un professeur prépare une activité expérimentale de synthèse du
paracétamol et fournit à l’agent de laboratoire une fiche de
préparation dont un extrait est reproduit ci-après :
Etapes du protocole de
synthèse :
Dans un erlenmeyer placer le para-aminophénol, l’eau distillée, le
solvant de synthèse et un barreau aimanté. Adapter un réfrigérant à air
et chauffer au bain-marie. Laisser refroidir. Ajouter l’anhydride
acétique et remettre au bain-marie.
Laisser refroidir à l’air puis dans un bain d’eau glacée. Filtrer
sous vide le solide obtenu. Mettre à l’étuve.
Déterminer la température de fusion du solide obtenu. Effectuer
une chromatographie sur couche mince avec 3 dépôts : para-aminophénol,
solide obtenu, paracétamol commercial, tous dissous dans l’éthanol.
Procéder à la recristallisation dans l’eau du solide obtenu. Filtrer
sous vide. Mettre à l’étuve.
Q21 - Donner la
formule semi-développée puis la formule brute de la molécule de
paracétamol synthétisée lors de cette expérience.
Q22 - Déterminer la
formule brute du produit secondaire X formé pendant cette synthèse.
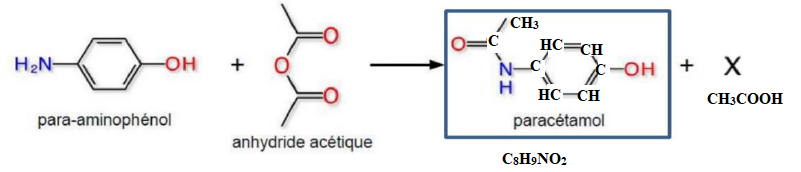
Q23 - Parmi les
produits à mettre à disposition, choisir ceux devant être installés
sous la hotte aspirante de la salle.
Para-aminophénol et anhydride éthanoïque.
Q24 - Expliquer la
différence entre les phrases de type H ainsi que celles de type P.
Mentions de danger (H) et consignes de prudence (P)
Q25 - Proposer le
matériel à disposer à proximité du flacon d’anhydride éthanoïque dont
un volume de 2,5 mL doit être prélevé par les élèves.
Pipette jaugée et pipeteur.
Q26 - Le
prélèvement précédent peut aussi être réalisé par pesée. Calculer la
masse d’anhydride correspondante.
Densité d = 1,08 ; masse à peser : 1,08 x 2,5 =2,7 g.
Q27 - Parmi les
dispositifs suivants, choisir celui qui est décrit dans le protocole
pour chauffer le milieu réactionnel lors de la synthèse :
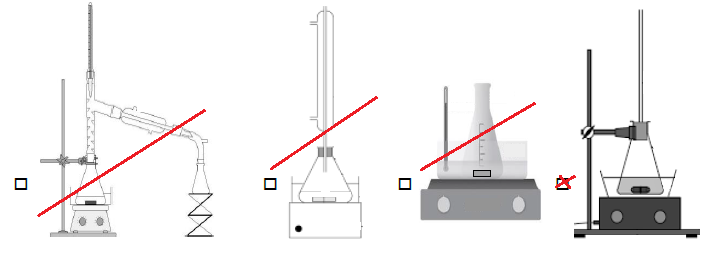
Q28 - Citer deux
intérêts d’un tel montage.
On accélère la réaction, la température est un facteur cinétique.
On évite les pertes de matière, les vapeurs se condensent dans le
réfrigérant et retombent dans le milieu réactionnel.
Q29 - Nommer le
matériel à installer pour l’étape de filtration sous vide.
Trompe à eau, cônes d'étanchéité, fiole à vide, entonnoir de Büchner,
tuyau à vide.
Q30 - Les élèves
utilisent l’étuve pour faire sécher leur solide récupéré après
filtration. Proposer une température adaptée de réglage de l’étuve.
Température inférieure à la température de fusion du paracétamol 169 °C
; par exemple 140 °C.
Q31 - Nommer
l’appareil représenté sur la photo ci-dessous.

Banc Kofler.
Q32 - Indiquer
comment étalonner cet appareil.
Utliser des solides étalons.
On déplace le chariot horizontalement jusqu'à ce que le curseur soit à
la frontière entre le solide et le liquide.
On déplace l'index mobile jusqu'à ce qu'il indique la température
de fusion de l'étalon.
Q33 - Pour la
préparation par les élèves des échantillons à déposer sur la plaque
CCM, le professeur a demandé à disposer de flacons compte-gouttes
d’éthanol. Lister les informations à indiquer sur l’étiquette de ces
petits flacons.
Para-aminophénol pur ; paracétamol pur ; produit de la synthèse.
Q34 - A la fin de
la séance les élèves mettent en oeuvre une recristallisation du
paracétamol solide synthéttisé. Donner le but et le principe de cette
technique expérimentale avant d’en décrire succinctement un protocole.
Permet de séparer l'aspirine des impuretés
en jouant sur la différence de solubilité du paracétamol et des
impuretés dan un solvant. On dissout l'ensemble à chaud dans le volume
miminum de solvant, puis on laisse refroidir.
Le paracétamol cristallise alors que les impuretés doivent rester dans
le solvant.
|
|