Mathématiques,
Chimie, concours
Police Technique et Scientifique 2022 ( zone Est).
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Question
1 : (2 points)
v est une suite définie sur N par vn = 1/(n+1)
Quelle est la limite de cette suite à l’infini ?
Le dénominateur tend vers plus l'infini et vn tend vers zéro.
Question 2-( 3
points)
Calculer la fonction dérivée f '(x) de la fonction suivante f(x)
définie sur R:
f(x)=(2x+1)*(x2-9).
On pose u = 2x+1 et v = x2-9 ; u' = 2 ; v' = 2x.
u'v+v'u = 2(x2-9)+2x(2x+1)=2x2-18+4x2+2x=6x2+2x-18.
Question 3- (
2points).
Le nombre ln(e2) + e est égal à :
a) 1+e
b) e+2 vrai
c) 1+ln(e+1).
ln(e2) = 2 ln(e) = 2 ; ln(e2) + e = 2+e.
Question
4-(2 points)
Exprimez A en fonction de ln 3.
A = ln 12 – ln 4.
A = ln (3 x4)-ln(4) = ln(3)+ln(4) -ln(4) = ln(3).
Résoudre dans l’équation e1-x = 2.
ln(e1-x) =ln(2) ; (1-x )ln(e) = l-x= ln(2) ; x=1-ln(2).
Question 5-(3
points).
La fonction f est strictement croissante sur [0;+∞[, et g est la
fonction définie par g(x) = e-f(x).
Sur [0;+∞[, la fonction g :
a- est strictement croissante
b- est strictement
décroissante vrai
c- change de variation.
f(x) est strictement croissante ; e-f(x)= 1/ef(x) est strictement décroissante
sur [0;+∞[
Question
6- 5 points.
X est une variable aléatoire qui suit la loi normale N (5;0,32).
a) Calculer P (X
< 4,5)
P(X < 4,5) =0,059.
b) Sachant que X
est supérieur à 6, calculer la probabilité que X soit inférieur à 7.
P(X < 7) =1 ; P(X < 6) =0,99911097 ; P(6
< X < 7) =0,000889.
Question 7-(6
points).
Un nouveau laboratoire d’analyses ADN a ouvert dans l’est de la
France. Depuis son ouverture il est très sollicité par les enquêteurs
qui font appel à ses services. Chaque jour, le nombre de requérants a
augmenté de 5 %.
Au soir du 10ème jour, le directeur du laboratoire a annoncé
à ses analystes qu’en 10 jours, le laboratoire avait reçu 1258 scellés
à analyser.
En utilisant les propriétés des suites géométriques, estimer combien de
scellés le laboratoire at-il reçu le jour de l’ouverture ?
Somme des termes de cette suite
géométrique : S = u 0(1-q 10) / (1-q)=1258.
q = 1,05 ; u0(1-1,0510)
/ (1-1,05)=1258.
0,6289 u0 / 0,05 =1258 ; u0 =100.
8 – Exercice –
PROBABILITES (7 points)
Une urne contient 5 boules numérotées de 1 à 5 : 2 rouges et 3 vertes.
a) On tire une
boule. Quelle est la probabilité qu’elle soit verte ?
3 / 5 =0,06.
b) 5 fois de suite,
on tire une boule puis on la repose dans l’urne.
Quelle est la probabilité de tirer 5 fois une boule rouge ?
Probabilité de tirer une boule rouge : p = 2 /5 = 0,4.
Probabilité de tirer 5 fois une boule rouge : 0,45=0,01024.
c) On tire successivement 3 boules
sans les remettre dans l’urne.
Quelle est la probabilité d’obtenir 2 vertes et 1 rouge ?
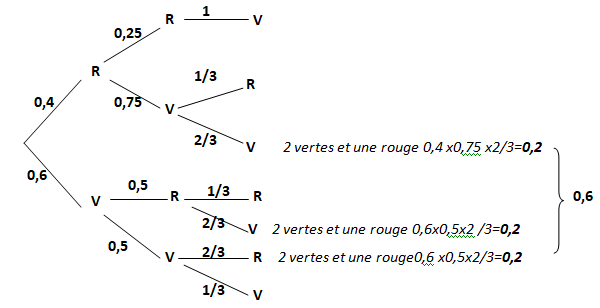
d) On tire
simultanément 3 boules.
Combien y a-t-il de combinaisons possibles ?
(5 3)=5! / (3!(5-3)!)=5 x4 /2=10.
|
...
|
....
|
Chimie
I – Élément chimique (7pts)
1 – Quel élément
chimique est représenté par le symbole 19 9F ?
A- le fer
B- le fluor vrai
C- le francium
2 – A quoi
correspond le nombre 19 ?
A- le nombre de nucléons vrai
B- le nombre de protons
C- le nombre d’électrons
D- le nombre de neutrons
3 – A quoi
correspond le chiffre 9 ?
A- le nombre d’électrons vrai
B- la masse atomique
C- le nombre de neutrons
4- En déduire la
formule électronique de ce corps ?
1s2 2s2 2p5.
5- A quelle famille
appartient cet élément chimique ?
Halogènes.
Citez 2 autres éléments chimiques qui appartiennent à cette même
famille.
Chlore, brome, iode.
II – Composés organiques
(15pts)
1- Soit la réaction
chimique suivante :
RCOOH + R'-OH --> RCOOR' + H2O.
acide carboxylique + alcool = ester + eau
A quelles familles appartiennent ces composés ?
2- En déduire le
nom de cette réaction ?
Estérification.
3- Écrire cette
équation pour R = CH3- et R’ = CH3-CH2-
.
H3C-COOH + H3C-CH2-OH
--> H3C-COOCH2-CH3 + H2O.
4- Quels sont alors
les noms des composés ?
acide éthanoïque + éthanol = éthanoate d'éthyle + eau
5- Dans un alcool,
qu’est-ce que le carbone fonctionnel ?
Le carbone lié à l'oxygène.
6- Combien y a-t-il
de classes d’alcool ? Comment s’appellent-elles ?
Comment sont-elles déterminées ?
alcool primaire : le carbone porteur de OH est lié à un seul autre
carbone.
alcool secondaire : le carbone porteur de
OH est lié à 2 autres carbone.
alcool tertiaire : le carbone porteur de OH
est lié à 3 autres carbone.
7-a) Écrire toutes
les formules semi-développées des alcools possédant 4 atomes de carbone.
b) Donnez les noms
des composés et leur classe.
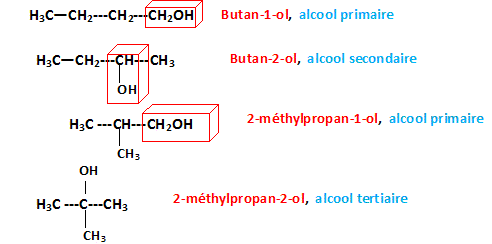
III – Oxydo-réduction
(12pts)
L’oxydation de l’acide 2-hydroxy-propanoïque par le dichromate de
potassium conduit à la formation de l’acide 2-oxo-propanoïque : l’acide
pyruvique.
L’ion dichromate Cr2O72- est, en
milieu acide un oxydant fort qui se transforme en ion Cr3+
1- Ecrire
l’équation de la réaction de transformation de l’acide
2-hydroxy-propanoïque en l’acide 2-oxo-propanoïque en plaçant le nombre
d’électrons qui interviennent.
H3C-CHOH-COOH = H3C-CO-COOH +2H+ + 2e-.
2- Ecrire
l’équation de la réaction de transformation de l’ion dichromate en ion
Cr3+en milieu acide en plaçant le nombre d’électrons qui
interviennent.
Cr2O72- aq +14H+aq
+6e- = 2 Cr3+aq +7 H2O(l)
- a) En conclure
le nombre de moles d’acide 2-hydroxy-propanoïque qui entre dans la
réaction d’oxydoréduction pour 1 mole d’ion dichromate.
b) Écrire la
réaction chimique d’oxydo-réduction.
3H3C-CHOH-COOH =3 H3C-CO-COOH +6H+ + 6e-.
Cr2O72- aq +14H+aq
+6e- = 2 Cr3+aq +7 H2O(l)
Ajouter et simplifier :
3H3C-CHOH-COOH +Cr2O72-
aq +14H+aq +6e-=3
H3C-CO-COOH +6H+ + 6e-+
2 Cr3+aq +7 H2O(l)
3H3C-CHOH-COOH +Cr2O72-
aq +8H+aq =3 H3C-CO-COOH
-+ 2 Cr3+aq +7 H2O(l)
3 moles d'acide propanoïque réagissent avec une mole d'ion dichromate.
4-
En supposant que la réaction soit totale, calculer la masse d’acide
2-hydroxy-propanoïque que l’on peut oxyder à l’aide de 200 mL d’une
solution de dichromate de potassium de concentration 51g/ L ?
La masse molaire du dichromate de potassium est de 294 g/mol
La masse molaire de l’ acide 2-hydroxy-propanoïque est de 90 g/mol.
Quantité de matière d'ion dichromate : n=0,2 x51 / 294 =0,0347 mol.
n(acide 2-hydroxy-propanoïque) = 3 n =0,1041 mol.
Masse : 0,1041 x90 = 9,37 ~9,4 g.
|
|