Mathématiques,
Chimie, concours
Technicien Police Technique et Scientifique 2021 ( zone Est).
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Question
1 : (3 points)
f(x) = (x3-3x2) / 3. Calculer f '(x).
f '(x) = (3x2-6x) / 3 = x2-2x.
Question 2-( 3
points)
f(x) = exp(x2). Calculer f '(x).
f '(x) = 2x exp(x2).
Question 3- ( 4 points).
Résoudre l'équation exp(x2-1) = e5.
x2-1 = 5 ; x2 = 6 ; x = ±6½.
Question
4-(4 points)
Exprimez les nombres suivants en fonction de ln(2)..
A = ln (8)=ln(23) = 3 ln (2).
B = 0,5 ln(16) = 0,5 ln(24) = 0,5 * 4 ln(2) = 2 ln(2).
Question 5-(6
points).
Au
cours d’une épidémie virale, on débute une phase de vaccination. Après
quelques mois, un quart de la population a pu être vacciné.
On constate néanmoins qu’un malade sur 10 est vacciné et que la
probabilité qu’une personne choisie au hasard soit malade est de 0,2.
Quelle est la probabilité pour qu’un individu vacciné soit malade malgré la vaccination ?

0,025 +0,75 x = 0,2 ; 0,75 x = 0,175 ; x ~0,233.
Question
6- 6 points.
Un responsable de laboratoire de police scientifique souhaite estimer
le niveau de satisfaction de ses 14 000 requérants, quant aux délais
des prestations réalisées par son laboratoire.
Il estime que les enquêteurs de Metz, représentant 80 requérants,
constituent un échantillon représentatif des enquêteurs ayant fait
appel à ses services. Il démarre donc une enquête de satisfaction.
Sur les 80 requérants sollicités, 66 déclarent qu’ils ont été satisfaits.
a- Quelle est, sur cet échantillon, la fréquence observée f de personnes satisfaites du délai de traitement de leurs dossiers ?
f = 66 / 80 =0,825.
b- Déterminer un intervalle de confiance 0,95 de la proportion p de
requérants satisfaits des délais de traitement. Les bornes de
l’intervalle seront arrondies au millième.
1 / 80½ =0,1118.
Interrvalle de confiance : [0,825 -0,1118 ; 0,825 +0,1118] soit [0,713 ; 0,934].
|
...
|
....
|
Chimie
1 – Une solution aqueuse est :
a. un mélange
b. un corps pur
c. constituée d’un ou plusieurs solutés dissous dans l’eau vrai
2 – On exprime la concentration en masse t d’une espèce chimique E grâce à la relation :
A- t = mE / Vsolution vrai
B- t = Vsolution / mE.
C- t = Vsolution . mE.
3 – L’unité de la concentration de masse peut être :
A. g L-1 vrai
B- g-1 L
C- g / L-1.
4 – Diluer deux fois une solution mère Sm pour préparer une solution fille Sf signifie que :
a. la concentration en masse de Sf est le double de celle de Sm
b. le facteur de dilution est égal à deux Vrai
c. l’on effectue deux fois la dilution
5 – La dimension d’un atome est :
a. de l’ordre du millimètre
b. de l’ordre de celle du noyau
c. 105 fois plus grande que celle du noyau vrai
6 – La masse de l’atome est concentrée dans :
a. le noyau vrai
b. les électrons
c. les protons
7 – Quel est le numéro atomique de l’atome d’oxygène :
a. 6
b. 3
c. 8 vrai
8 – Sur un spectre infra-rouge, on trouve généralement en ordonnée :
a. la longueur d’onde
b. le nombre d’onde
c. la transmittance vrai.
9 – Le spectre donné ci-dessous :
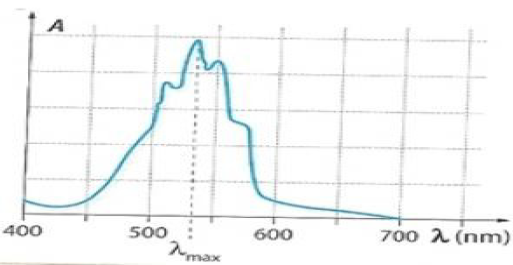
a. est un spectre UV-visible vrai
b. est un spectre IR
c. est un spectre RMN
10 – L’antimoine est un élément qui peut être recherché sur des victimes ou suspects suite à une fusillade. Quel est son symbole :
a. An
b. Sb vrai
c. A
11 – La molécule ci-dessous possède :
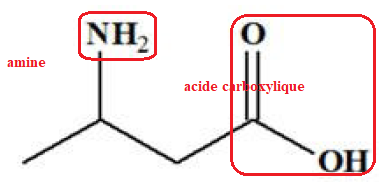
a. une fonction cétone, une fonction amine et une fonction alcool
b. une fonction amide et une fonction alcool
c. une fonction amine et une fonction acide carboxylique. Vrai.
12 – Donner le nom de la molécule suivante : CH3-CH2-OH
a. méthanol
b. éthanol vrai
c. propan-1-ol.
13 – Sur une plaque CCM a été déposée une goutte de chacune des solutions suivantes :
- huile essentielle de clous de girofle en A
- eugènol en B
- acétyleugénol en C

a. l'huile essentielle est un corps pur
b. l'huile essentielle contient de l'eugénol vrai
c. l'huile essentielle ne contient pas de l'acéthyleugénol
14 – La densité :
a. est une grandeur sans unité. Vrai
b. peut s'exprimer en g . mL-1
c. peut s'exprimer en g . L-1.
15 – L’équation de combustion de l’éthanol est :
C2H5OH +3 O2 -> 2 CO2 + 3 H2O
Quel est le nombre de moles de dioxyde de carbone formées lorsqu’on
fait brûler totalement 0,5 mole d’alcool ? Indiquer le calcul opéré de
votre réponse.
0,5 x2 = 0,1 mol.
16 – L’isotope d’un élément est un atome qui a :
a. un nombre différent de protons mais pas de neutrons
b. un nombre différent de neutrons mais pas de protons vrai
c. la même masse mais un nombre différent d’électrons
17 – Le carbone-14 est :
a. un isotope du carbone-12 vrai
b. un isotope de l’azote-14
c. un atome qui n’est synthétisé que dans des réacteurs nucléaires.
18 – À propos des composés covalents :
a. une liaison covalente se forme entre deux éléments qui ont une faible électronégativité
b. une liaison covalente se forme entre deux éléments qui ont une grande électronégativité
c. une liaison covalente se forme entre deux éléments qui ont une grande différence d’électronégativité
La différence d'électronégativité entre les deux atomes doit être faible.
19 – L’équation-bilan d’une réaction chimique signifie que :
a. les coefficients
des réactifs et des produits sont donnés de manière à respecter la loi
de la conservation de la matière vrai
b. l’état de la matière des réactifs et des produits est indiqué
c. la masse des réactifs et des produits est indiquée.
20 – La ninhydrine
(2,2-dihydroxyindan-1,3-dione) est utilisée pour révéler des traces
papillaires, en police scientifique, grâce à sa réaction avec les
acides aminés.
Pour équilibrer la réaction ci-dessous, quel est le coefficient à appliquer au C9H6O4 :
C9H6O4 + NH2-CHR-COOH --> CO2 + C18H9NO4 + R-CH=O + 3 H2O
a. 1
b. 2 vrai
c. 3
21 – La molécule H2O est un ampholyte car :
a. elle peut jouer le rôle de base ou d’acide en fonction du couple considéré vrai
b. c’est une base forte
c. elle ne porte pas de charge.
22 – Quelle définition du pH est juste ?
a. pH=log(H3O+)
b. pH= - log(H3O+) vrai
c. pH=10-pKa.
23 – Quelle affirmation concernant l'autoprotolyse de l'eau est fausse ?
a. c’est une réaction acido-basique
b. c’est une réaction totale faux
c. c’est une réaction très limitée.
24 – Quel pH correspond à une solution basique ?
a. pH=4
b. pH=7
c. pH=10 vrai
25 – La constante d’acidité associée à un couple acide/base est :
a. Ka = [base] [H3O+] / [acide] vrai.
b. Ke = [H3O+] [HO- ]
c. Ka = [acide] [H3O+] / [base].
26 – Qu’a découvert Marie Curie ?
a. le radium vrai
b. le plutonium
c. le curium
27 – À t=0, un
échantillon contient N noyaux radioactifs de demi-vie t½= 30 min. Que
peut on dire de l’échantillon au bout d’1 h 30 min ?
a. 1/8 ème des noyaux se sont désintégrés
b. il reste 1/3 ème de la population initiale
c. l’intégralité des noyaux se sont désintégrés
1 H 30 = 3 t½ ; 23 = 8.
A caque t½, N initial est divisé par 2.
Au bout de 3 t½, le nombre de noyaux initiaux sera divisé par 8.
28 – Dans le Système International, l'activité d'une source radioactive se mesure en :
a. Becquerel vrai
b. Curie
c. Sievert
29 – Dans la molécule de dichlore un atome de chlore est entouré de :
a. 4 électrons
b. 7 électrons
c. 8 électrons vrai
30 – Soit les molécules A et B ci-dessous :
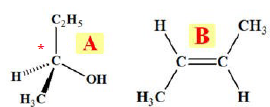
a. elles sont toutes les deux chirales
b. elles sont toutes les deux achirales
c. A est chirale et B est achirale. Vrai.
|
|