|
enregistrement vidéo d'un mouvement ; dosage conductimétrique ; synthèse de l'aspirine ; les solvants ; acide bromhydrique En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
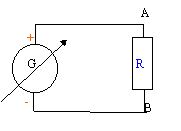
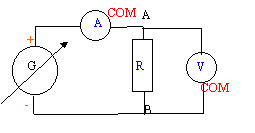
On veut connaître la valeur d'une résistance R.
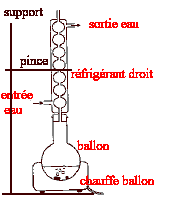
On réalise le corcuit ci-dessous : uG= 6 V ; L= 0,5 H ; C= 5 mF ; r = 1 W et R est variable. 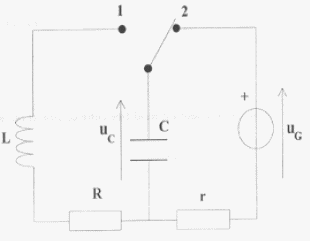 On souhaite visualiser sur l'écran d'un ordinateur relié à une interface les tensions uG sur la voie 1 et uC sur la voie 2.
corrigé jaune- violet : 47 ; noir : fois 1 soit R = 47 W. tolérance 5% : 47*0,05 = 2,4 W donc 47-2,4 <R<47 + 2,4 ; 45,6< R<49,4 W. On peut mesurer rapidement la valeur avec un ohmètre.
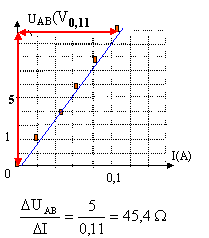
loi d'Ohm pour un résistor : UAB = R I La tension (volt) aux bornes du résistor est proportionnelle à l'intensité (A) du courant qui le traverse. La courbe est une droite dont le coefficient directeur donne la valeur de R. On trouve une valeur en accord avec celle de la question 1. 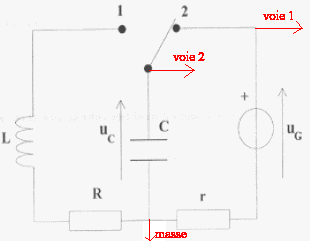
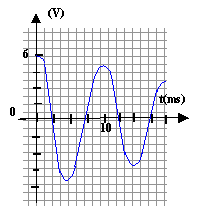
r est faible et lorsque le régime permanent est établit on visualise sur la voie 1 la tension uG, l'intensité étant alors nulle, la tension aux bornes de r est nulle. Lorsque l'interupteur est en position (2) le condensateur se charge. La charge est terminée lorsque la tension uC vaut 6 V. T0= 2p racine carrée (LC) = 6,28 ( 0,5 * 5 10-6)½ = 0,01 s = 10 ms Pour visualiser plusieurs pseudo-périodes ( une dizaine) la durée de la mesure doit être de l'ordre de 100 ms soit 0,1 s. Pour faire apparaître la courbe il faut un grand nombre ( plusieurs centaines) de points donc 5000 mesures par seconde c'est à dire 500 mesures en 0,1 s.
si R augmente légèrement, alors l'amortissement augmente un peu et l'amplitude sera un peu plus faible.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
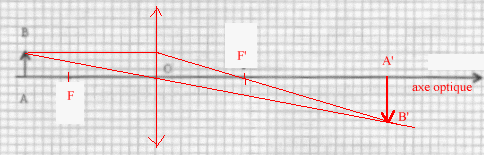
On veut préparer un montage illustrant le principe du projecteur de diapositives en cherchant à obtenir sur un écran l'image réelle d'un objet réel à l'aide d'une lentille. On dispose de quatre lentilles : L1 : -10 d ; L2 : -5 d ; L3 : +5 d ; L4 : +20 d.
corrigé La lentille L2 est divergente : ces bords sont plus épais que la partie centrale ; la lentille L3 est convergente : ces bords sont plus minces que sa partie centrale. symbole de la lentille L2 divergente >----------< Les indications donnent la vergence de chaque lentille, négative pour une lentille divergente. Pour obtenir une image réelle plus grande d'un objet réel il faut une lentille convergente L3 ou L4. La distance focale image OF' est l'inverse de la vergence : OF'= 0,2 m ; vergence = 1/0,2 = 5 d ( L3)
formule de conjugaison : 1/OF' = 1/OA'- 1/OA ; OF', OA', OA sont des grandeurs algébriques. 1/OA' = 1/OF' + 1/OA avec 1/OF' = 5 et OA = -0,3 m 1/OA' = 5+ 1/(-0,3)= 1,67 ; OA'=0,6 m. D'après le schéma, l'image A'B' est à droite de la lentille : cette image est réelle L'image est de sens contraire à l'objet et sa dimension est environ deux fois celle de l'objet : donc le grandissement est proche de -2 Image C On améliore la qualité de l'image en diaphragmant : on élimine ainsi les rayons lumineux trop inclinés sur l'axe optique et on se rapproche des conditions de Gauss permettant d'obtenir une image nette.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On désire effectuer avec une caméra vidéo l'enregistrement de la trajectoire d'une balle de golf lancée avec une vitesse initiale non verticale devant le tableau d'une salle de classe. On dispose par ailleurs d'un téléviseur et d'un magnétoscope. Enregistrement du mouvement :
Obtention et exploitation de la chronophotographie du mouvement : On utilise un magnétoscope relié à un téléviseur. On dispose un transparent sur l'écran du téléviseur et on pointe la position du centre de la balle lors du défilement de l'enregistrement image par image. On obtient la trajectoire suivante : 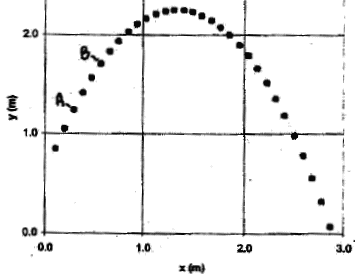
corrigé 25 images par seconde. Pour une bonne qualité de l'image, les prises de vues sont effectuées en maintenant le camescope fixe. Pour obtenir un enregistrement satisfaisant du mouvement, il faut filmer dans la direction perpendiculaire au plan du mouvement à étudier, en plaçant la caméra à une distance de l'ordre de grandeur des dimensions du mouvement ( 2 à 4 m). Pour exploiter les mesures de distance il faut filmer en même temps que le mouvement de la balle, une règle graduée verticale placée en arrière plan : cela nous donne une échelle des distances. calculer la vitesse moyenne du centre de la balle entre les points A et B : mesurer la distance AB et tenir compte de l'échelle :AB ---> 2 cm ( mesure sur le graphe) or 3,5 cm correspondent à 1 m d'où AB = 2/3,5 voisin 0,6 m durée entre deux images consécutives : 1/25 = 0,04 s durée du parcours AB = durée séparant 4 images consécutives = 3*0,04 = 0,12 s vitesse moyenne (m/s) = distance (m) / durée (s) = 0,6 / 0,12 = 5 m/s. Une durée d'exposition de 1/1000 s n'entraîne pas une imprécision signifiactive sur les résultats car la durée séparant deux images consécutives est très supérieure à 1/1000.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Dans un
bécher, on introduit un volume V1 = 10,00
mL d'une solution de permanganate de potassium de
concentration C1 inconnue , 2,5 mL d'acide
sulfurique de concentration égale à 1 mol/L et
200 mL d'eau distillée. La solution de sel de Mohr
contenant les ions Fe2+ de concentration
C2 = 0,100 mol/L est ajoutée dans la
burette graduée. On effectue le titrage en suivant
à l'aide d'un conductimètre, les variations de
la conductance G de la solution contenue dans le becher en
fonction du volume de solution de sel de Mohr versé.
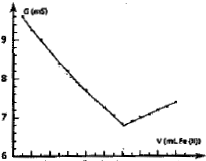
On obtient la courbe ci-dessous : couples redox mis en jeu :
MnO4- / Mn2+ ;
Fe3+ / Fe2+. masse atomique molaire (g/mol) : H: 1 ; O: 16 ;
Mn : 55 ; S: 32 ; Fe : 55,8 ; N : 14.
corrigé 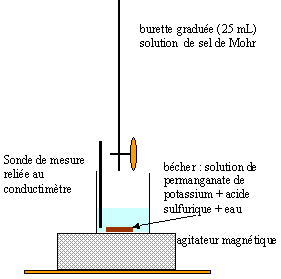
permanganate de potassium solide KMnO4 et de l'acide sulfurique H2SO4. prélever les 10,00 mL de solution de permanganate de potassium à l'aide d'une pipette jaugée. On ajoute 200 mL d'eau afin que l'extrémité de la sonde du conductimètre soit correctement immergée. la couleur
de la solution contenue dans le bécher est violette.
masse de sel de Mohr solide doit-on peser pour préparer 100 mL de solution de concentration C2 = 0,1 mol/L Qté de matière de sel de Mohr (mol) = concentration (mol/L) * volume solution (L) = 0,1*0,1 = 0,01 mol masse (g) =
masse molaire (g/mol) * Qté de matière (mol) =
391,8 * 0,01 = 3,92
g.
5 Fe2+ = 5 Fe3++ 5 e- nom de l'ion Mn2+ : ion manganèse II
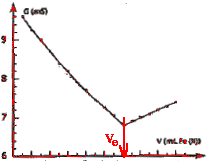
On détermine le volume équivalent à l'intersection des deux droites. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoéchiomètriques. MnO4- : concentration (mol/L) * volume (L) =C1*V1 =0,01 C1 mol ion
Fe2+ : C2*Ve = 0,1 *12,1
10-3 =1,21 10-3 mol récupération des déchets : solution de permanganate oxydante : bidon jaune contenant les oxydants la solution du bécher contient des ions Fe3+ : bidon bleu contenant les métaux..
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
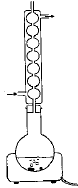
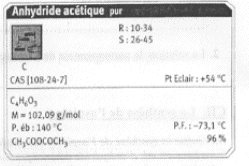
On introduit 10 mL d'anhydride éthanoïque (acétique) dans un ballon bien sec. Ajouter ensuite 5,00 g d'acide salycilique, quelques gouttes d'acide sulfurique concentré et des grins de pierre ponce. Chauffer pendant 20 min en maintenant la température vers 60°C. L'anhydride éthanoïque est en excès. L'équation de la réaction s'écrit : 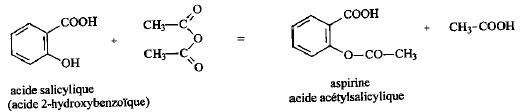
corrigé
R signifie : risques ; S signifie : sécurité point éclair : température la plus basse à laquelle la concentration de vapeurs émises est suffisante pour produire une déflagration au contact d’une flamme, d’une étincelle, d’un point chaud mais insuffisante pour produire la propagation de la combustion en l’absence de la "flamme pilote" . l'anhydride à 25°C est liquide : la température de fusion est -73,1 °C et la température d'ébullition est : 140°C. précautions à prendre pour manipuler l'anhydride acétique : travailer sous hotte , port de blouse, gants et lunette. L'acide salicylique : C7H6O3 ; groupe acide carboxylique -CO2H et groupe phénol -OH fixé sur le cycle benzénique. 1ère manipulation : hydrolyse de l'anhydride acétique en excès en acide acétique 2ème manipulation : précipitation de l'aspirine d'autant moins soluble dans l'eau que la température est plus basse.
cyclohexane : C6H12 ; acétone : CH3-CO-CH3. Le produit A conduit à deux taches sur le chromatogramme : A est un mélange contenant de l'aspirine et de l'acide salicylique.
L'indication 254 nm signifie : la longueur d'onde de la
radiation UV est 254 nanomètre. Les composés solides obtenus par synthèse organique ou extraits de substances naturelles sont couvents contaminés par de faibles quantités d’impuretés. La technique habituelle de leur purification est la recristallisation, basée sur leur différence de solubilité à chaud et à froid dans les solvants. La plupart des composés organiques fondent entre 50 et 300 °C. Le point de fusion (température de fusion) est un critère de pureté très utilisé : une substance solide pure présente un point de fusion bien net, le passage de l'état solide à l'état liquide se faisant sur un intervalle de température de moins de 1 °C. Par contre, un produit impur fond mal, sur un intervalle de température de plusieurs degrés, en passant par un état intermédiaire pâteux. La mesure du point de fusion d'un composé solide se fait à l'aide d'un appareil appelé "banc Köfler". Il s'agit d'une plaque chauffante, présentant un gradient de température (de 50 à 250 °C, pour l'appareil ci-dessous), aussi régulier que possible.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
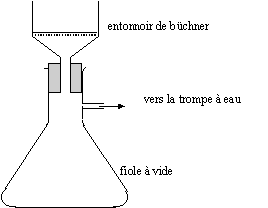
corrigé Pour extraire une espèce E d'un solvant S, il faut un autre solvant S', non miscible avec S, et dans lequel E soit plus soluble. Lors de l'agitation du solvant S contenant E avec le solvant S', l'espèce E passe, en grande partie, dans S'. Pour séparer par décantation les phases constituées par S et S', il est nécessaire que les solvants S et S' aient des densités différentes.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On dispose d'une sloution commerciale d'acide bromhydrique à 46% en masse, de densité d=1,47. Masse molaire HBr : 81 g/mol.
corrigé La masse de 1 L de solution commerciale est : 1470 g. Cette solution contient : 1470*0,46 = 676,2 g d'acide bromhydrique pur. Qté de matière (mol) = masse (g) / masse molaire (g/mol) = 676,2 / 81 = 8,35 mol dans 1 L C= 8,35 mol/L facteur de dilution = concentration mère / concentration fille = 8,35 / 0,1 = 83,5 volume de solution commerciale à prélever : 1000 / 83,5 = 12 mL. Pour préparer 1 L d'une solution d'acide bromhydrique à 0,10 mol/L à partir d'une solution commerciale A à 8,35 mol/L, on doit prélever 12 mL de la solution A à l'aide d'une pipette jaugée, puis verser dans une fiole jaugée de 1 L , compléter avec de l'eau distillée jusqu'au trait de jauge puis agiter pour homogénéiser. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|