|
d'après bac Antilles juin 2004 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
|
demi équation
électronique associée au coupleI2 / I- RCOO- forme oxydante et RCOH forme réduite du couple RCOO- / RCOH la solution
restant colorée, elle contient encore du diiode : le réactif limitant
est donc le glucose.
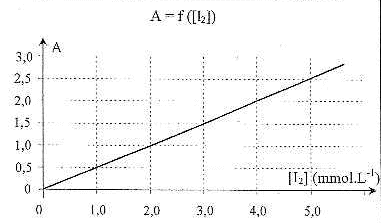
( solvant) nG= n0- nR= 4 10-4-nR. La courbe est une droite passant par l'origine : l'absorbance et la concentration en diiode sont proportionnelles. Le coefficient directeur de la droite est proche de : 2,5 / 5 10-3 = 500 L/mol concentration en diiode restant en solution : 1,5 / 500 = 3 10-3 mol/L la quantité de matière de diiode restant nR = volume fiole jaugée (L) * concentration (mol/L) nR = 0,05*3 10-3 = 1,5 10-4 mol d'où nG = (4-1,5) 10-4 = 2,5 10-4 mol dans 2 mL de jus de fruit. soit 2,5 10-4*1000/2 = 0,125 mol dans 1L masse de glucose dans 1 L : 0,125*180 = 22,5 g. |
|||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||
|
|