|
La phase aqueuse
du Pétrole Hahn contient du chlorure de sodium. Pour connaître la
concentration du chlorure de sodium dans la phase aqueuse du Pétrole
Hahn, on dose les ions chlorure par les ions argent(I). Il y a
formation de chlorure d’argent très peu soluble. La réaction peut être
considérée comme quasi totale.
- Ecrire
l’équation de la réaction associée à ce dosage.
- On suit le
dosage par conductimétrie. L’eau pure conduit-elle le courant
électrique ?
- Quelle est la relation entre la conductance G et la résistance R
d’une solution ?
- Quelle est l’unité de conductance ?
- La conductance G est reliée à la conductivité, notée s, de la solution par la constante de cellule k
: s = k · G. Quelle est l’unité de
conductivité ?
- De quels paramètres dépend k ?
- Calculer la valeur de la conductivité d’une solution de chlorure de
sodium de concentration molaire C égale à 0,100 mol.L-1
après avoir donné l’expression littérale correspondante.
Données : Conductivités molaires ioniques en S·m2·mol-1
lH3O+ =34,98 10-3
; lHO- =19,92 10-3
; lNa+ =5,01 10-3
;lCl- =7,63 10-3
; lAg+ =6,2 10-3
;lNO3- =7,14 10-3
;
- Définir
l’équivalence d’un dosage.
- Faire un bilan des espèces présentes avant l’équivalence. En déduire
l’expression de la conductivité de la solution en fonction des
conductivités molaires ioniques et des concentrations des espèces
chimiques présentes.
- Faire un bilan des espèces présentes après l’équivalence. En déduire
l’expression de la conductivité de la solution en fonction des
conductivités molaires ioniques et des concentrations des espèces
chimiques présentes.
- Résultats
expérimentaux : suivi conductimétrique du dosage de 10,0 mL de phase
aqueuse de pétrole Hahn+200 mL d’eau par une solution de nitrate
d’argent de concentration molaire 1,00×10-2 mol.L-1.
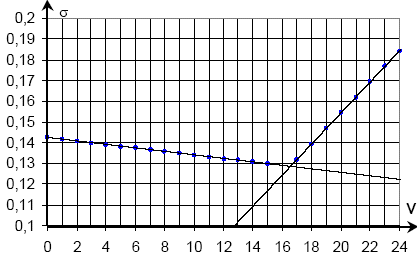
- Donner une
explication à la rupture de pente à l’équivalence.
- Pourquoi a-t-on ajouté 200 mL d’eau dans la solution à doser ?
- Exploiter les résultats du dosage pour déterminer la valeur de la
concentration molaire des ions chlorure dans la phase aqueuse du
pétrole Hahn
corrigé
Ag+ + NO3- + Na+
+ Cl- = AgCl(s) + Na+ + NO3-
Très faiblement :
les ions oxonium et hydroxyde sont présents à la concentration molaire
10-7 mol.L-1.
G = 1/R ;
conductance exprimée en siemens (S) et résistance exprimée en ohm.
La conductivité s s'exprime en S.m-1.
k dépend de la
géométrie de la cellule ( k = largeur(m) / section m² )
-
s = lNa+[Na+]+lCl-[Cl-], concentration en mol m-3
soit 100 mol m-3.
s = 100 × (5,01×10-3
+ 7,63×10-3) = 1,26 S.m-1.
-
équivalence
: changement de réactif limitant.
Proportions
stoechiométriques pour le réactif titrant et l’espèce à doser.
avant
l'équivalence Na+ , Cl-
et NO3-
ajoutés sont présents
-
s = lNa+[Na+]+lCl-[Cl-]+ lNO3-
[NO3-]
après
l'équivalence Na+ , Ag+
et NO3-
ajoutés sont présents
s = lNa+[Na+]+lAg+[Ag+]+ lNO3-
[NO3-]
• Avant
l’équivalence tout se passe comme si on remplaçait les ions chlorure
par les ions nitrate :
s diminue lentement carlNO3- voisine de lCl-
• Après
l’équivalence, la solution s’enrichit en ions nitrate et en ions
argent(I) : s augmente rapidement.
-
on
ajoute 200 mL d’eau dans la solution à doser pour ne pas avoir à tenir
compte de la dilution, le volume de la solution varie peu lors de
l'ajout du nitrate d'argent.
volume
équivalent VE=16,5 mL ;
les quantités de
matière de réactifs sont en proportions stoéchiomètriques à
l'équivalence :
10,0 [Cl-] = 16,5 ×1,00×10-2
[Cl-] = 1,65×10-2 mol.L-1.
|
