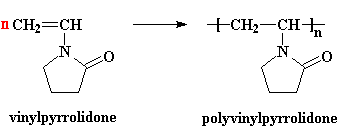|
acide thiolactique ; vinylpyrrolidone d'après bts esthétique cosmétique 2004 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|
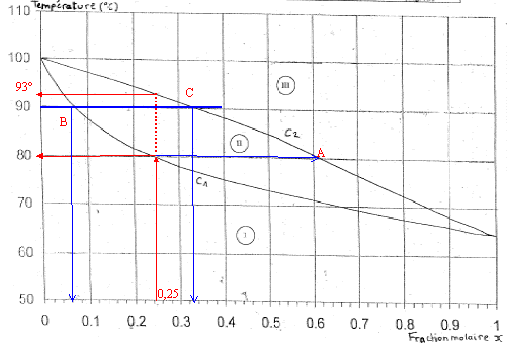
Données pour les trois exercices : C: 12 ; H : 1 ; O : 16 ; S : 32 ; N : 14 ; Cl : 35,5 g/mol ; masse molaire M ( acide thiolactique) = 106 g/mol ; pKa ( NH4+ / NH3)=9,3 ; pKe = 14 On donne le diagramme binaire, isobare à pression atmosphérique normale ( 1,013 105 Pa; 1,013 bar ) du mélange méthanol eau : q = f(x) où x représente la fraction molaire du méthanol et q la température du mélange en °C. 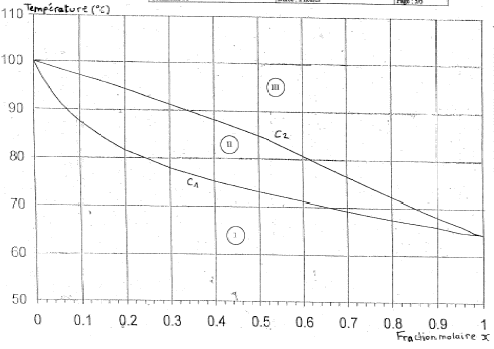
corrigé C1 : courbe d'ébullition ; C2 : courbe de rosée I : domaine du liquide II : domaine du mélange liquide vapeur en équilibre III : domaine de la vapeur température d'ébullition : eau 100°C ; méthanol : 65 °C masse molaire méthanol : 12+4+16 = 32 g/mol ; eau : 18 g/mol Qté de matière (mol) = masse (g) / masse molaire ( g/mol) n(méthanol) = 160/32 = 5 mol ; n(eau) = 270/18=15 mol ; total mole : 20 fraction molaire du méthanol : 5/20 = 0,25 .
Les premières vapeurs, dont la composition est donnée par le point A, apparaissent à 80°C. La vaporisation du liquide s'arrète lorsque tout le liquide a disparu : la vapeur a alors la composition du mélange liquide initial ; la température est alors voisine de 93°C. Le point B donne la composition du liquide : x(méthanol) = 0,06 le point C donne la composition de la vapeur : x(méthanol) = 0,33.
|
||||||||||||||||||
|
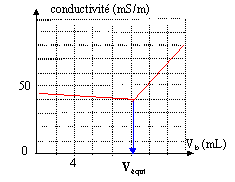
corrigé NH4+ + H2O = NH3 + H3O+. Ka = [NH3][ H3O+] /[NH4+ ] relation valable si la solution n'est pas trop concentrée( sinon il faut tenir compte des interactions entre ions) et si la solution n'est pas trop diluée ( sinon il faut tenir compte des ions oxonium et hydroxyde issus de l'eau). pH= ½(14+9,3 + log 0,05) = 11. La solution de chlorure d'ammonium a un pH voisin de 6 ( présence de l'acide NH4+). A l'équivalence du dosage acido-basique la base NH3 prédomine en solution : le pH équivalent sera supérieur à 10. Le saut de pH ne sera pas net, et en conséquence l'équivalence sera difficile à déterminer avec précision. NH4+ + HO- = NH3 + H2O
à l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques : Véqui Cb = 10 C soit C =Véqui Cb / 10 =10*0,1 / 10 = 0,1 mol/L masse molaire NH4Cl : M = 14 + 4 +35,5 = 53,5 g/mol titre masique ( g/L) = concentration molaire ( mol/L) * masse molaire ( g/mol) = 0,1 *53,5 = 5,35 g/L. NH4+ + Cl-+ HO- + Na+= NH3 + H2O+ Na+ + Cl-. à l'équivalence les seuls ions présents sont Na+ et Cl-. Quantité de matière n ( Na+)= n(Cl-)= Véqui Cb = 10 10-3 *0,1 = 10-3 mol volume du mélange à l'équivalence : 300 +10 +10 = 320 mL = 0,32 L = 0,32 10-3 m3. [Na+]=[Cl-]= 10-3 / 0,32 10-3 = 3,125 mol m-3. s = lNa+ [Na+] + lCl- [Cl-] s = (5 10-3 + 7,6 10-3) 3,125 = 3,94 10-2 S/m. écart relatif à la valeur mesurée : (4,3 - 3,94) / 4 *100 = 9 % le calcul et la valeur mesurée sont en accord à 9% près. Un courant électrique alternatif alimente la cellule conductimétriqueafin d'éviter les dépôts chimiques ( solide ou gaz) par électrolyse : cela modifierait la conductance de la portion de solution comprise entre les deux plaques.
|
|||||||||||||||||||
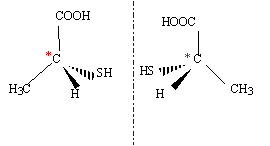
corrigé CH3-CH2- SH les électronégativités de l'hydrogène et du soufre étant voisines, la molécule d'éthanethiol est peu polaire : en conséquence celle-ci sera peu soluble dans l'eau. acide thiolactique : CH3-CHSH-COOH La présence d'un carbone asymétrique conduit à l'existence de deux isomères optiques.
réducteur : espèce, ion ou molécule susceptible de céder des électrons au cours d'une réaction d'oxydation oxydant : espèce, ion ou molécule susceptible de gagner des électrons au cours d'une réaction de réduction I2+ 2e- = 2I- HOOC-CH(CH3)-S-S-CH(CH3)
-COOH + 2H+ +2e- = 2 CH3-CHSH-COOH
I2+2 CH3-CHSH-COOH = HOOC-CH(CH3)-S-S-CH(CH3) -COOH + 2H+ + 2 I- d'après les coefficients stoechiomètriques, à l'équivalence : n( acide thiolactique) = 2 n(I2) n(I2) = [I2] Véqui = 0,13 * 8,8 10-3 = 1,144 10-3 mol n( acide thiolactique) = 2 * 1,144 10-3 = 2,288 10-3 mol masse molaire acide thiolactique M = 3*12+6+2*16+32=106 g/mol masse (g) = Qté de matière (mol) * masse molaire (g/mol) = 2,288 10-3*106 = 0,24 g. % massique : 0,24 /20
*100 = 1,21 %.
l'inversion de l'atome d'azote peut être ralentie ou même bloquée quand l'atome d'azote est engagé dans un système ponté .
grande famille de polymères à laquelle appartient le polyvinylpyrrolidone : polymères vinyliques
|
|||||||||||||||||||
|
|
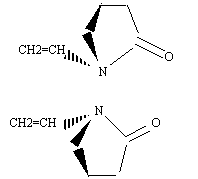
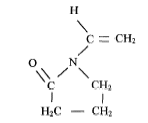 est
le monomère permettant de fabriquer le polyvinylpyrrolidone, utilisé
dans les shampoings ou d'autres produits à cause de son effet filmogène.
est
le monomère permettant de fabriquer le polyvinylpyrrolidone, utilisé
dans les shampoings ou d'autres produits à cause de son effet filmogène.