Le gout sucré d'une substance est défini par le pouvoir sucrant (P.S).
P.S : rapport entre les masses de saccharose et de substance sucrée présentes en solution aqueuse et provoquant la même saveur sucrée.
P.S: dépend de la concentration de saccharose exprimée en pourcentage massique.
| P.S de l'aspartame | 400 | 215 | 133 | 100 |
| % saccharose | 0,34 | 4,3 | 10 | 15 |
1. Donner la relation entre le pouvoir sucrant et les titres massiques de l'édulcorant et du saccharose. Pourquoi le P.S n'a pas d'unité ?
- Titre massique T.M(g/L).: rapport m/V , m étant la
(g) soluté présente dans le volume V (L)de solution.
- Pourcentage massique P.M.: raport m/M , m étant la masse de soluté présente dans la masse M de solution; ce rapport étant exprimé en pourcentage. IL s'agit du rapport de 2 grandeurs de même espèce, exprimée dans la même unité, donc d'un nombre sans unité.
- Concentration molaire C (mol/L): rapport n/V , n étant la
de matière (mol) du soluté présente dans le volume V (L) de solution.
Masse de saccharose présente dans un volume V de solution : TM(saccharose.)*V
Masse d'édulcorant présent dans le même volume V : TM(édulcorant.)*V.
P.S : rapport entre les masses de saccharose et de substance sucrée présentes en solution aqueuse et provoquant la même saveur sucrée.
PS = TM(saccharose)
par TM(édulcorant).
IL s'agit du rapport de 2 grandeurs de même espèce, exprimées dans la même unité, donc d'un nombre sans unité.
2. Que penser du therme "concentration" dans la définition du P.S ?
Le terme " concentration " devrait être remplacé par "
massique"
3. On considère une solution de saccharose
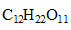
, de concentration C=5,0*10 exposant -3 mol/L.
- Quel est son titre masique ?
- Quelle est la concentration molaire d'une solution de glucose
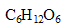
, ayant la même saveur sucrée ; le P.S du glucose étant égal à 0,70 ?
M (g/mol) étant la masse molaire du soluté :
TM = m(g) / V(L) et n (mol) = m(g) / M (g/mol) d'où : T.M = n M/V = M*(n/V) = M * C
TM (g/L)= M (
)* C (
) .
M(saccharose)= 12*12+22+11*16 = 342 g/mol
TM( saccharose)= 342* 5 10 exposant -3 =
g/L.
PS(glucose) = TM(saccharose)/TM(glucose)
d'où : TM(glucose) = TM(saccharose) / PS(glucose) = 1,71/0,7 =
g/L
M(glucose)= 6*12+12+6*16=180g/mol
C(glucose) = TM(glucose) / M(glucose)= 2,44/180 =
mol/L
4. Quel est le titre massique d'une solution de saccharose à 10% de pourcentage massique et de densité d=1,1 ?
Quelle serait la masse d'aspartame
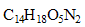
présente dans 100 mL d'une solution de cet édulcorant présentant la même saveur sucrée que la solution de saccharose à 10% de pourcentage massique.
(On précise que le P.S de l'aspartame est égal à 133, et on prendra comme masse volumique de l'eau la valeur de 1,0 g/mL)
masse de 1 L de solution : 1100 g
masse de saccharose dans cette solution 1100*0,1 =
g.
TM (saccharose)= m(g)/V(L) = 110 g/L
PS(aspartame) = TM(saccharose)/TM(aspartame)
TM(aspartame) =TM(saccharose)/PS(aspartame) = 110 / 133 =
g/L
Soit dans 100 mL =0,1 L de solution d'aspartame 0,83 * 0,1= 0,083 g =
mg.