Un alliage de cuivre et d'argent de masse égale à 6,54 g est chauffé avec de l'acide sulfurique concentré. Il se produits les réactions d'équations :
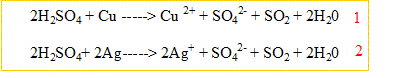
Après refroidissement, le volume de gaz dégagé à 25°C est sous une pression de 1,02 10 exposant 5 Pa vaut 1,43 L
Calculer les pourcentages en masse de cuivre et d'argent contenus dans cet alliage.
Masse atomique molaire en g/mol : Cu : 65,4 ; Ag : 108. R= 8,31 SI
On note x la quantité de matière (mol) de cuivre dans l'alliage et y la quantité de matière (mol) d'argent dans l'alliage.
On note Mcu la masse (g) de cuivre dans l'alliage et Mag la masse (g) d'argent dans l'alliage.
La masse de l'alliage est égale à la somme des masses des 2 constituants : Mcu + Mag= .

Mcu = ; Mag = ; 65,4x+108y=6,54 (3)
D'après les coeficients stoechiomètriques de l'équation 1, la quantité de matière de dioxyde de soufre est à la quantité de matière de cuivre.
D'après les coeficients stoechiomètriques de l'équation 2, la quantité de matière de dioxyde de soufre est égale à la de la quantité de matière d'argent.
Qté de matière de dioxyde de soufre : n(SO2)= x + 0,5y.

V= 1,43 10 exposant mètre cube ; T= 273+25 = 298 .
n(SO2)=1,02 10^5 * 1,43 10^-3 /( 8,31*298)= 10 exposant -2 mol.
5,89 10^ -2 = x + 0,5 y (4)
Résoudre le système de deux équations à deux inconnues (3) et (4).
(4) s'écrit : x= 5,89 10^ -2 - 0,5 y
repport dans (3) : 65,4 (5,89 10^ -2 - 0,5 y)+108y=6,54
3,85 -32,7y + 108y=6,54
75,3 y = 2,69
y = 3,57 10^ -2 mol
x= 5,89 10^ -2 - 0,5 *3,57 10^ -2 = 4,10 10^ -2 mol
masse de cuivre : 4,10 10^ -2* = 2,68 g.
masse d'argent : 3,57 10^ -2 *108 = g
On vérifie : 2,68 + 3,86 = 6,54.
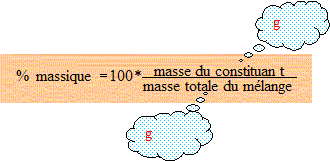
% massique du cuivre : 100*2,68/6,54 = %
% massique de l'argent : 100*3,86/6,54 = 59,0 %.