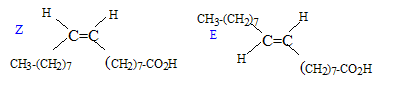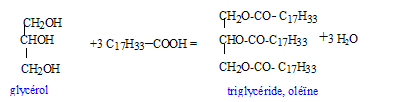|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
||
|
|
glycérol : HO-CH2-CHOH-CH2OH ( 2 fonctions alcool primaire et une fonction alcool secondaire). La molécule n'est pas chirale : absence de carbone asymétrique.( carbone tétragonal portant 4 substituants différents) estérification, lente, athermique, limitée par l'hydrolyse du triester
On utilise un excès d'acide oléique afin de déplacer l'équilibre vers la formation de l'ester ( obtention d'un meilleur rendement) On chauffe pour accélérer la réaction et atteindre plus rapidement l'équilibre.
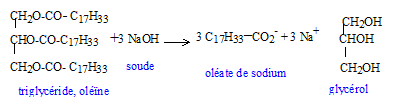
saponification, lente mais totale :
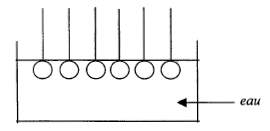
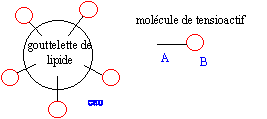
réactif nucléophile HO- : savon obtenu : oléate de sodium masse de savon théoriquement obtenu en faisant réagir une masse d'oléine notée moléine avec un excès de soude : n( oléine) =moléine / Moléine d'après les coefficients de l'équation : n( savon) =3 n( oléine) = 3moléine / Moléine or n( savon) =msavon / Msavon d'où msavon = 3 moléineMsavon / Moléine partie hydrophile : groupe COO- symbolysé par "O" et partie hydrophobe de cet ion : la chaîne carbonée symbolysée par "---------". ions carboxylates à la surface de l'eau : ions carboxylate sur une tache de graisse (lipide) :
|
|
|
|