|
D'après
concours Fesic (
chimie) 2006
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
|
|
répondre
vrai ou faux.
Masses atomiques molaire en g/mol : H : 1 ; C
: 12 ; O : 16 ; Na : 23 ; Cd : 112,4 ; Ni : 58,7.
- On mesure l'absorbance d'une solution de sulfate de
cuivre ( Cu2++ SO42-)
a) L'absorbance augmente avec la concentration molaire en soluté
apporté de la solution. vrai
b) La courbe représentant l'évolution de
l'absorbance A avec la concentration molaire en soluté apporté est une
droite pour les faibles concentrations. vrai
c) L'absorbance ne dépend pas de la longueur
d'onde de la lumière utilisée. faux
Une solution
de concentration molaire en soluté apporté c1=0,100
mol/L a une absorbance A1=0,30. Une solution de
concentration molaire en soluté apporté c2=0,050
mol/L a une absorbance A2=0,15.
d) Le mélange à volume égal de ces deux
solutions a une absorbance A=0,45. faux. Mélangeons 500 mL de chaque
solution ; n(Cu2+) = ½ (c1+c2)
dans 1 L de mélange ; concentration et absorbance étant
proportionnelles, d'où l'absorbance A du mélange A= ½(A1+A2).
- On On réalise
l'étude cinétique de la transformation des ions peroxodisulfate par les
ions iodure. Le mélange réactionnel est réalisé avec un volume V1=25,0
mL de solution de peroxodisulfate de potassium de concentration molaire
en soluté apporté c1 = 5 mmol/L et un volume V2
de solution d'iodure de potassium de concentration molaire en soluté
apporté c2 = 0,250 mol/L, de sorte que l'un des
réactifs soit en large excès.
L'équation bilan s'écrit : S2O82-
+ 2I-= 2SO42-+I2.
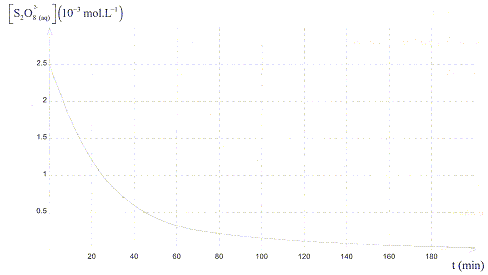
Un graphe indiquant la variation de la concentration molaire en ions S2O82-
en fonction du temps a été tracé :
a) l'ion
peroxodisulfate joue le rôle d'oxydant. vrai.
b) L'ion iodure est le réactif limitant. faux.
D'après le graphe, à t >180min [S2O82-
] est nulle ; S2O82-
est le réactif limitant.
c) V2=25 mL. vrai (
lecture graphe) [S2O82-
]0 = 2,5 10-3 mol = 2,5
mmol = C1V1/(V1+V2)
; V1+V2
= 5 *25/2,5 = 50 mL ; V2 =25 mL.
d) Le temps de demi réaction est légérement inférieur à 20 min. vrai
lecture graphe pour [S2O82-
] =½[S2O82-
]0 =1,25 10-3 mol/L.
|
|
- L'eau de Javel est désinfectant, elle est
fabriquée en solution aqueuse selon la réaction quasi-totale : Cl2(g)
+ 2HO- = ClO- + Cl-
+ H2O. (1)
Le degré chlorométrique (°CHl) est le volume exprimé en L de dichlore
gazeux qui a été utilisé pour préparer un volume de 1,00 L d'eau de
Javel. Vm=22,4 L/mol. On considère de l'eau de
Javel à 48,0°CHl.
a) Dans ces conditions, 60 L de dichlore gazeux sont
nécessaires pour préparer 500 mL d'eau de Javel. faux. 48°CHl soit 48
L de dichlore pour préparer 1L ou 24 L de dichlore pour préparer ½L.
b) La concentration molaire en ion hypochlorite ClO-
est environ égale à 2,1 mol/L. vrai.
n(Cl2) = 48/22,4 = 2,1
mol dans 1 L ; de plus n(Cl2) =n(ClO-).
La teneur en ion hypochlorite diminue au cours du temps car les ions se
transforment lentement en ion chlorure avec dégagement de dioxygène
suivant la réaction : ClO- = Cl-+½O2
(2). On étudie la cinétique de cette décomposition.
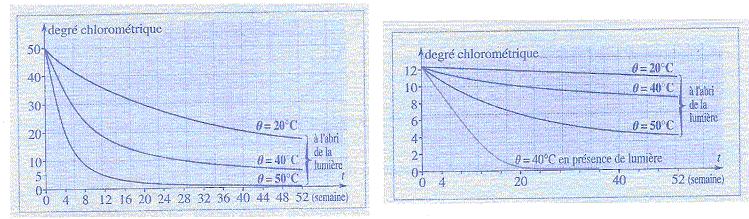
c) La température et l'absence de lumière sont deux
facteurs cinétiques qui font évoluer le système dans le même sens. faux.
si la température augmente la vitesse de la réaction
augmente ; à la lumière la réaction est plus rapide
pour une même température.
Lors de sa fabrication un berlingot d'eau de Javel contient 0,50 mol
d'ion hypochlorite. Lors de son utilisation, 6 mois plus tard, il ne
contient plus que 0,48 mol. Le volume d'un berlingot est 250 mL
d) La vitesse moyenne volumique de la réaction n°2 est égale à 3 mol L-1
mois -1. faux.
diminution de 0,08 mol par litre en 6 mois soit
0,08/6 =0,013 mol L-1 mois -1.
- On réalise le mélange de V1=20,0
mL de permanganate de potassium de concentration molaire en soluté
apporté C1=2,00 10-3
mol/L et V2 = 20,0 mL d'acide oxalique HOOC-COOH
( solution incolore) de concentration molaire en soluté apporté C2
= 5,00 10-2 mol/L. La réaction mise en jeu est
lente et considérée comme totale, son équation est : 2 MnO4-
+ 5 H2C2O4
+ 6H+ = 2Mn2+ + 8H2O+
10 CO2.
On suit son évolution par spectrophotométrie. On mesure l'absorbance A
du mélange réactionnel placé dans la cuve du spectrophotomètre. Dans
ces conditions, la concentration molaire en ion permanganate est
proportionnelle à la valeur de l'absorbance A. L'absorbance A(t) et
l'avancement de la réaction x(t) sont reliès par la relation : x(t) =
(2 10-5 -A(t) 10-5) mol.
Par un logiciel approprié on obtient la courbe suivante :
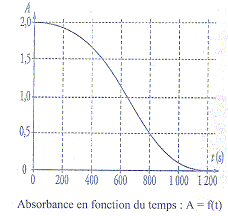
a) L'un des couples
d'oxydoréduction mis en jeu dans la réaction chimique est CO2/H2C2O4.
vrai.
b) Le temps de demi réaction est égale à 650 s. vrai. à t½
l'avancement est égal à la moitié de l'avancement
final ; Afin =0 d'où xfin
=2 10-5 mol ;
xt½= 10-5 mol d'où At½=1
; puis lecture graphe : t½ voisin 650 s.
On recommence l'expérience précédente en prenant le même volume V2
d'une nouvelle solution d'acide oxalique de concnetration molaire en
soluté apportée C'2 = 2,50 10-3
mol/L
c) La solution finale n'est plus incolore. vrai.
n(MnO4-)0
= C1V1 = 40 10-3
mmol ; n(H2C2O4)0
= C'2V2 = 50 10-3
mmol ;
à partir de 50 10- 3 mmol d'acide oxalique on
consomme 50 10- 3 /2,5 = 20 10-3
mmol d'ion permanganate ; ce dernier est en excès de 20 10-3
mmol.
d) L'absorbance finale vaut 1.vrai
La quantité de matière finale d'ion permanganate est
égale à la moitié de la quantité initiale de cet ion ; l'absorbance
initiale vaut 2 ; volume constant ; ; absorbance et concentrations sont
proportionnelles.
- On prépare une solution aqueuse à 5 10-3
mol/L d'acide méthanoïque. La conductivité de la solution, mesurée à 25
°C a pour valeur s= 3,3
10-2 S/m.
Données : 4,05*8,1 = 33. l(H3O+)=35
10-3 S m² mol-1 ; l(HCOO-)=5,5
10-3 S m² mol-1.
a) L'ancien nom de l'acide méthanoïque est acide acétique. faux.
b) Les ions méthanoate et les ions oxonium sont quasiment en même
quantité dans la solution. vrai .
La
solution est électriquement neutre : [HCOO-]+ [HO-]=[H3O+]
et [HO-] négligeable en milieu acide.
c) [H3O+]
= 0,81 mmol/L. vrai
s = l(H3O+)[H3O+]
+ l(HCOO-)[HCOO-]=(
l(H3O+)+l(HCOO-))[H3O+]
; [H3O+]=3,3
10-3 /((35+5,5)10-3)=3,3/40,5
=0,81 mol m-3 = 0,81 mmol/L
d) Le
taux d'avancement de la réaction est égal à 16 %. vrai
[H3O+]
= t c ; t =[H3O+]
/c = 0,81 10-3 / 5 10-3
= 0,81/5 = 0,0162 soit 16,2%.
|
|
acide
base
- L'acide borique H3BO3
est utilisé comme antiseptique en solution aqueuse, par exemple dans
les collyres. On considèrera ici qu'il s'agit d'un monoacide. On
souhaite réaliser un dosage pH-métrique de 20 mL d'une solution de cet
acide par une solution d'hydroxyde de sodium. La solution titrante a
une concentration de 1,0 10-2 mol/L. On obtient
les courbes suivantes pH=f(V) et dpH/dV= g(V).
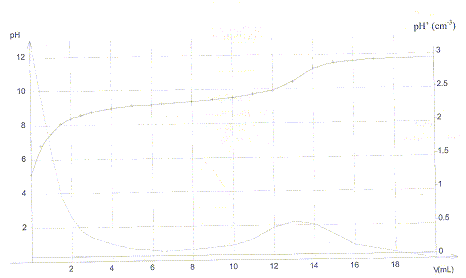
a) La base conjuguée de l'acide borique est BO2-.
faux H2BO3-.
b) On peut également détecter l'équivalence avec la phénolphtaléine
dont la zone de virage se situe entre pH=8,2 et pH=10. faux. le pH du point
équivalent pH voisin de 11 n'appartient pas à la zone de virage de cet
indicateur..
c) D'après le graphe le pKa de l'acide borique est compris entre 8 et10.vrai
pKa = pH à la demi-équivalence soit pour un volume
de soude voisin de 6,5 mL.
d) La concentration molaire de la solution d'acide borique a une valeur
proche de13 10-3 mol/L.faux
volume équivalent : 13 mL d'où C = 13*0,01 / 20 =
6,5 10-3 mol/L.
- Une espèce chimique A réagit sur une espèce chimique
B. L'équation de la réaction est modélisée par : aA+bB=cC+dD. Le
diagramme d'évolution théorique des quantités de matière des réactifs
est représenté ci-dessous :
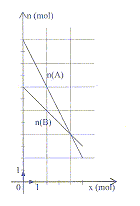
a) Les nombres stoéchiomètriques a et b sont dans le
rapport a/b=2. vrai.
les valeurs absolues des coefficients directeurs des
droites n(A) = f(x) et n(B) = g(x) donnent a=2 et b=1.
b) L'espèce B est le réactif limitant. faux.
n(A) = f(x) couperait la première l'axe des
abscisses.
c) L'avancement maximal est égal à 4 mol. faux.
|
avancement (mol)
|
aA
|
+bB
|
=cC
|
+dD
|
|
initial
|
0
|
12
|
8
|
0
|
0
|
|
en cours
|
x
|
12-ax = 12-2x
|
8-bx=8-x
|
cx
|
dx
|
|
fin
|
xmax = 6 mol
xfin = 5 mol
|
12-2xmax=0
|
8-xmax = 2 mol
|
cxmax
|
dxmax
|
d) Le taux d'avancement final est voisin de
t = 0,8. faux
t = xfin
/xmax = 5/6 .
- On considère la réaction d'autoprotolyse de l'eau
Ke(25) = 1,0 10-14 ; Ke(60) = 1,0 10-13
à 60°C.
Données : NA= 6,02 1023 mol-1
; masse volumique de l'eau = 1 g/mL à 25°C
a) L'eau est un ampholyte. vrai.
elle peut jouer le rôle d'acide ou le rôle de base.
b) Il y a plus de molécules d'eau dissociées en ions à 60°C qu'à 25°C. vrai. Ke(60)
> Ke(25)
c) Dans 1 L d'eau à 25°C il y a 6,0 1016
molécules d'eau dissociées en ions. vrai.
10-7 mol dion oxonium ; donc
10-7 mol de molécules d'eau dissociées soit 10-7
*6,02 1023 =6,02 1016
molécules d'eau dissociées.
d) à 60°C une solution de pH=7 est acide. faux
à 60°C le milieu neutre a un pH égal à 6,5 ; pH=7
est un milieu basique.
- L'éthylamine C2H5NH2
est une base de Brönsted. L'acide conjugué est l'ion éthylammonium C2H5NH3+.
On prépare une solution aqueuse d'éthylamine à 0,020 mol/L. Le pH de
cette solution vaut 11,9.
Données : pKa( C2H5NH3+
/C2H5NH2
)= 10,7 ; log 5,0 10-4 = -3,3 ; log 5,0 10-13
= -12,3 ;
a) l'éthylamine possède un isomère. vrai. CH3-NH-CH3.
: diméthylamine
b) l'éthylamine est complétement dissociée dans l'eau. faux ; sinon le pH de
la solution serait égal à 14+log0,01 = 12 ; or on mesure une valeur
inférieure à 12.
c) La constante de réaction de l'éthylamine avec l'eau est égal à K=
5,0 10-4. vrai
C2H5NH2
+ H2O = C2H5NH3+
+ HO- ; K= [C2H5NH3+][HO-
]/[C2H5NH2]
; or Ka =[C2H5NH2][H3O+]/
[C2H5NH3+]
;
K=Ke/Ka = 10-14 / 10-10,7
= 10-3,3 = 5,0 10-4
d) On dose 20 mL de la solution d'éthylamine par une solution d'acide
chlorhydrique à 0,025 mol/L. Le
volume équivalent est: VE=16 mL. vrai
20*0,02 =0,025 VEsoit
VE=16 mL .
- Le calcaire CaCO3 peut se
dissoudre en présence de CO2. l'équation de la
réaction s'écrit : CaCO3 (s)+ CO2
+H2O = 2HCO3-+Ca2+.
La constante d'équilibre de cette réaction est K= 3,5 10-6.
a) L'expression de la constante est K= [HCO3-]éq²[Ca2+]éq
/[CO2]éq. vrai.
Les concentrations molaires initiales sont : [HCO3-]0=8,0
10-4 mol/L ; [Ca2+]0
=3,8 10-4 mol/L ;[CO2]0=1,0
10-2 mol/L.
b) Le quotient de réaction initial vaut Qr i =
3,0 10-5. faux.
Qr i =(8,0 10-4)2
*3,8 10-4 / 1,0 10-2 =2,4
10-8.
c) Dans ces conditions le calcaire se dissout. vrai.
Qr i < K donc
évolution dans le sens direct.
d) Le pH de la solution initiale vaut 7,5. faux.
Données : pH=pKa + log([base]/[acide] ; 8,0*3,8 =30 ; 8,02*3,8 = 240 ;
log (1/8 10-2)=1,1 ; log 8 10-2 = -1,1 ;
pKa (CO2 ,H2O / HCO3-
) = 6,4
log ([HCO3-]0
/ [CO2]0 )=log(8
10-4 / 10-2) =-1,1 ; pH=
6,4-1,1 = 5,3).
|
|
Pile-
électrolyse
- Un dentiste pose une couronne en or à côté d'une
couronne en acier ( alliage fer carbone contenant une grande proportion
de fer). Il se forme alors une pile schématisée de la façon suivante :
Fe(s) / Fe2+(aq) //H+
(aq)/H2(g). L'électrode constituée par la
couronne d'or reste inaltérée et le couple en jeu à cette électrode est
le couple H+ (aq)/H2(g).
de nombreuses boissons jouent le rôle de solutions électrolytiques.
a) La couronne d'acier va être rapidement fragilisée
par la réaction d'oxydation du fer, la manipulation du dentiste n'est
pas judicieuse. vrai.
b) La couronne d'or constitue le pôle positif de cette pile. vrai. réduction de H+,
donc cathode positive.
On considère maintenant une pile classique formée d'une électrode
inattaquable plongeant dans 100 mL d'une solution acide à C= 0,100
mol/L et d'une électrode de fer en large excès, plongeant dans une
solution de nitrate de fer de concentration molaire C.
On considère la réaction Fe(s) = 2H+(aq) = Fe2+(aq)
+ H2(g) dont la constante d'équilibre a pour
valeur K= 2 1015 à 25°C.
Après calcul, le quotient de réaction dans l'état initial vaut Qr
i = 1/C.
c) Le système évolue dans les sens inverse de la réaction considéré. faux. Qr i
= < K, évolution dans le sens direct.
d) La charge transférée au cours de l'évolution du système vaut 965 C. vrai n(H+)
=0,01 mol ; or H++e- = ½H2
donc n(e-) = 0,01 mol ;
Q= 96500*0,01 = 965 C.
- Le nickel métallurgique obtenu à partir du minerai
contient des impuretés. On le purifie par électrolyse. L'électrolyte
utilisé est du sulfate de nickel. L'une des électrode A est une plaque
de nickel à purifier. L'autre B est une plaque de nickel pur. Pendant
l'électrolyse, le nickel contenu dans A s'oxyde et disperse ces
impuretés dans la solution électrolytique. La réaction qui a lieu dans
l'électrolyseur est : Ni(s) + Ni2+(aq) = Ni(s) +
Ni2+(aq)
Le générateur débite un courant d'intensité I= 2,0 A constant sous une
tension U= 4,0 V pendant 5,0 h.
Données : 965/36=27.Ni : 58,7 g/mol
a) Le nickel impur constitue l'anode. vrai.
anode = "oxydation " du métal impur.
b) Les cations se déplacent vers la cathode. vrai.
c) L'avancement de la réaction au bout de 5 h est de 0,050 mol. faux. Q=It = 2*5*3600
= 36 000 C ; Q= 96 500 n(e-) ; n(e-)
= 36000/96500 = 360/965=10/27 = 0,373 mol d'électrons ; or
Ni(s) = Ni2+(aq) + 2 e- ;
avancement x =n (Ni2+) = ½ n(e-)
= 5/27 =0,186 mol .
d) L'expérience permet de déposer une masse de nickel pur supérieure à
8,0 g. vrai. n
(Ni) = ½ n(e-) = 5/27 ; masse
= nM = 5/27*58,7 = 10,9.
- Le cadmium métallurgique est produit industriellement
par électrolyse d'une solution acidifiée de sulfate de cadmium II.
Cette électrolyse est réalisée sous une tension de 3,1 V. On considère
un électrolyseur qui produit 1 tonne de cadmium en 24 h. Couples redox
: Cd(s) / Cd2+(aq) ; H+(aq)
/H2(g) ; O2(g) / H2O(l).
96,5/ (112,4*24*36) = 10-3.
a) L'électrode où se forme le cadmium est reliée à la borne négative du
générateur. vrai. cathode
négative = " réduction " des ions cadmium.
b) Il se forme du dihydrogène à l'anode. faux.
anode = "oxydation " de l'eau en dioxygène.
c) Il se forme du dioxygène à l'anode. vrai
.
d) L'intensité du courant vaut 25 000 A. faux.
n(Cd) = m/M = 106/112,4 mol ;
or Cd2+ + 2e- = Cd(s)
d'où n(e-) =2*106/ (112,4)
Q= 96500 n(e-) = It soit I= 96500 n(e-)
/ t = 2*96500 106/ (112,4*24*3600) =
96,5/ (112,4*24*36) *2 107 = 2104
= 2 104A.
|
|
chimie
organique
- Une huile alimentaire est constituée d'un
triglycéride appelé oléine (M= 884 g/mol) dont la formule semi
développée est :
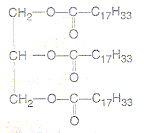
On chauffe à reflux un mélange constitué de 88,4 g
d'oléine, 100 mL d'éthanol, une solution d'hydroxyde de sodium en
excès. Après 25 min on laisse refroidir le contenu du ballon, puis on
verse celui-ci dans 250 mL d'une solution saturée en chlorure de
sodium. On filtre sur bûchner et on rince le savon obtenu à l'eau
froide. On prépare une solution d'eau savoneuse en disolvant des
copeaux de savon dans un peu d'eau.
a) L'un des produits de la réaction est le glycérol.
vrai.
b) La solution saturée de chlorure de sodium permet d'éliminer la soude
en excès. faux. relargage,
précipitation du savon.
c) La réaction produit 91,2 g de savon. vrai.
n (oléine) = 88,4/884 = 0,1 mol donc 0,3 mol de
savon ( oléate de sodium C17H33COO
Na : M= 304 g/mol) ; masse de savon = nM = 0,3*304 =91,2 g .
d) Un papier pH trempé dans l'eau savonneuse révèle un pH basique. vrai. présence d'une
base, l'ion oléate C17H33COO-.
- L'eugénol extrait de l'huile essentielle des clous de
girofle est utilisé dans certains produits des domaines médical et
dentaire en raison des propriétés entalgiques et antiseptiques.
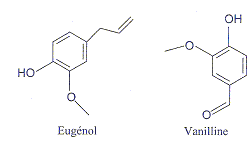
a) La vanilline est un ester de l'eugénol. faux.
b) La vanilline possède une fonction aldehyde. vrai.
groupe carbonyl >C=O en bout de chaine.
c) La molécule ci-dessous est l'acétate d'eugényle
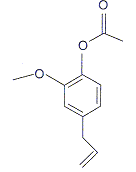 vrai. vrai.
d) On réalise l'estérification par l'acide acétique
d'une mole d'eugénol et, après extraction, on récupère 103 g d'acétate
d'eugényle. Le rendement de la
réaction est 50%. vrai.
M( eugénol) = 12*10+12+32=154 g/mol ; M ( acétate
d'eugényle) =12*12+14+48=206 g/mol ; on peut obtenir au maximum 1 mol
d'ester soit 207 g.
- A 25°C on étudie par conductimétrie la cinétique de
l'hydrolyse basique d'un ester RCOOR'. La quantité de soude introduite
est 10 mmol. L'ester est en excès. En fin de réaction, la conductance Gf
de la solution est 9,1 mS. Le mélange réactionnel est très dilué.
|
ion
|
l en
S m² mol-1
|
|
H3O+
|
3,5 10-2
|
|
HO-
|
2,0 10-2
|
|
Na+
|
5,0 10-3
|
|
RCOO-
|
4,1 10-3
|
a) Il s'agit d'une réaction totale. vrai.
b) La conductivité du mélange réactionnel augmente au cours du temps. faux. du point de
vue de la conductimétrie, on remplace HO- par
RCOO- de conductivité molaire ionique beaucoup
plus faible.
c) L'avancement final est xf = 10 mmol. vrai. soude en défaut.
d) La conductance initiale de la solution est G0
= 25 mS. vrai.
G0 = l(HO-)[HO-]+l(Na+)[Na+] =(l(HO-)+l(Na+))[HO-]0 =
2,5 10-2[HO-]0 =
2,5*10 10-5/V ;
G=l(Na+)[Na+]+l(RCOO-)[RCOO-] =(l(RCOO-)+l(Na+))[RCOO-]f
=9,1 10-3[RCOO-]f =9,1*10
10-6/V = 9,1 10-3
S d'où V=10-2 m3 ;
G0 =2,510-4/10-2
=25 mS
|
|
retour
-menu
|







 vrai.
vrai.