|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
||
|
|
On se propose de doser par pH-métrie un vinaigre afin d'en déterminer la concentration molaire volumique en acide éthanoïque. Pour cela on prépare un volume V= 100 mL d'une solution diluée 10 fois du vinaigre. Puis on prélève un volume v1 = 10 mL de la solution diluée que l'on verse dans un bécher. On réalise le dosage avec une solution d'hydroxyde de sodium de concentration molaire c2 = 0,1 mol/L. 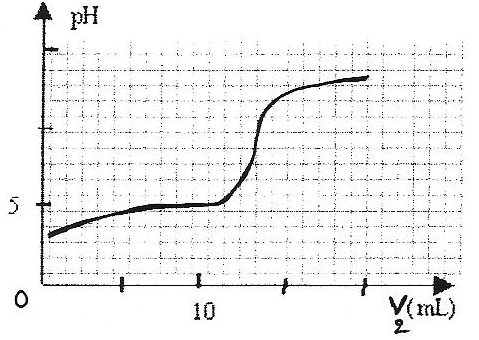
pKa ( CH3COOH / CH3COO-) = 5,0 ; pKe = 14 à 25°C.
le quotient de réaction lorsque le système chimique est à l'équilibre est égal à la constante Ka : Q r éq =[CH3COO-]/ ([CH3COOH][HO-]) Or Ka = [CH3COO-][H3O+]/ [CH3COOH] soit [CH3COO-]/ [CH3COOH] =Ka/[H3O+] Q r éq = Ka/([H3O+][HO-]) = 10-5/10-14 = 109. valeur qui ne dépend que de la température et non pas de la composition initiale du système. le pH est basique à l'équivalence : la solution contient une base CH3COO- en quantité majoritaire. à l'équivalence les quantités de matière d'acide et de base sont en proportions stoechiomètriques : c1 v1 =c2v2, eq ; c1 =c2v2, eq /v1 = 0,1*13/10 = 0,13 mol/L en tenant compte de la dilution : c = 1,3 mol/L. |
|
|
|
||
corrigé MnO4- + 8 H+ + 5e- = Mn2+ + 4H2O réduction 5 Fe2+ = 5Fe3+ + 5e- oxydation MnO4- + 8 H+ +5 Fe2+ = 5Fe3+ + Mn2+ + 4H2O On doit ajouter de l'acide sulfurique au mélange réactionnel : les ions oxonium apportés par l'acide sont l'un des réactifs et l'ion sulfate est spectateur. masse de sel de Mohr à dissoudre dans 500 mL d'eau pour obtenir un solution de concentration c=0,2 mol/L : n( sel de Mohr) = cV = 0,2*0,5 = 0,1 mol m = n M = 0,1*392 = 39,2 g. concentration massique de l'ion fer II dans cette solution : [Fe2+]*M(fer) = 0,2*56 = 11,2 g/L. dans quel sens va évoluer la réaction : Qr i = [Fe3+]i 5[ Mn2+]i / ([Fe2+]i 5[MnO4-]i [H+]i 8) volume du mélange 100 mL ; sulfate de fer III : Fe2(SO4)3 = 2 Fe3+ + 3 SO42- ; n(Fe3+) i =2*0,1*50 = 10 mmol [Fe3+]i =10/100 = 0,1 mol/L. n(Mn2+) i =1*10 = 10 mmol [Mn2+]i =10/100 = 0,1 mol/L. n(Fe2+) i =1*10 = 10 mmol [Fe2+]i =10/100 = 0,1 mol/L. n(MnO4-) i =0,5*20 = 10 mmol [MnO4-]i =10/100 = 0,1 mol/L. acide sulfurique : n(H+) i =1*10 = 10 mmol [H+]i =10/100 = 0,1 mol/L. Qr i =0,15 *0,1 / (0,15 *0,1*0,1 8)=1/0,1 8= 108 Qr i < K donc évolution dans le sens direct, de gauche vers la droite.
|
||
|
Un flacon possède une étiquette humide avec l'intitulé " solution aqueuse CH3-OOC-H"
corrigé Nom et fonction chimique : méthanoate de méthyl ; ester. saponification ou hydrolyse basique de l'ester : CH3-OOC-H + HO- = HCOO- + CH3-OH on ajoute une solution d'acide sulfurique en excès ; les réactions acide base sont : HO- en excès : HO- + H3O+ = 2H2O et HCOO- + H3O+ = HCOOH + H2O
|
||
|
Les questions 1 et 2 sont indépendantes. L'hydrure de lithium LiH est une solution ionique constituée d'ion lithium Li+ et d'ion hydrure H-. Une fois ce solide dissout dans l'eau, les ion H-(aq) réagissent totalement avec l'eau selon l'équation : H-(aq) + H2O = H2(g) + HO-(aq)
corrigé les deux couples acide / base : H2O / HO-(aq) : H2O = H+ (aq) + HO-(aq) H2(g) / H-(aq) : H2(g) =H+ (aq)+ H-(aq) les deux couples oxydant-réducteur : H2(g) / H-(aq) : H2(g) +2 e- = 2H-(aq) H2(g) joue le rôle d'oxydant et H-(aq) joue le rôle de réducteur. H2O / H2(g) : 2H2O + 2 e- = H2(g) + 2 HO-(aq)
|
||
|
|