La radioactivité est une réaction dite
nucléaire car elle concerne le noyau de l'atome alors que les réactions
chimiques ne concernent que le cortège électronique sans modifier le
noyau.
équation
de la désintégration b-
du carbone 14 :
146C
= AZX + 0-1e
conservation de la charge : 6=Z-1 soit Z= 7 , donc
X est l'élément azote N
conservation du nombre de nucléons : 14 = A+0 soit
A= 14.
A(t)
en fonction de N(t) et l
: A(t) = l N(t)
équation
différentielle vérifiée par le nombre N(t) de noyaux :
A(t) =
-dN(t)/dt et A(t) = l
N(t)
d'où : dN(t)/dt
+ l N(t) =0 (1)
N(t) = N0
exp(-lt) ; dériver par rapport au temps : dN(t)/dt
= -lN0 exp(-lt) = -lN(t)
repport dans (1) : -lN(t) + l
N(t) =0 est vérifié pout tout t
donc N(t) = N0 exp(-lt) est solution de (1).
temps
de demi-vie :
La demi-vie radioactive,(ou
période) notée t½, d'un échantillon de noyaux radioactifs est égale à
la durée au bout de laquelle la moitié des noyaux radioactifs initiaux
se sont désintègrés.
activité
de cet échantillon aux instants t½, 2 ½,
3½, 4½, et 5½
:
A(t½)
= A0/2 ; A(2t½) = A0/22
; A(3t½) = A0/23
; A(4t½) = A0/24
; A(5t½) = A0/25
.
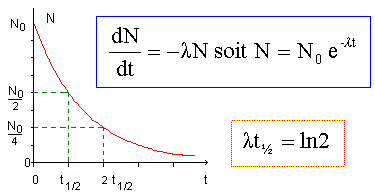
de même A(t) =A0
exp (-lt)
relation
entre l et t½ :
à t = t½, A(t½)
= ½A0 = A0 exp (-lt½) ; 0,5 = exp (-lt½) ; ln 0,5 = -lt½ ; ln2 = lt½
dans le cas du
carbone 14 : l= ln2/t½ = 0,69 / 5570 =1,24 10-4
an-1.
ou bien
0,69/(5570*365*24*3600) = 3,93 10-12 s-1.
l'âge
T de ces ossements :
N/N0=1,64
10-2 ; d'autre part N/N0=exp(-lT)
ln 1,64 10-2
= -4,1 = -lT ; T= 4,1 / l= 4,1 / 1,24 10-4
=3,30 104 ans.
activité
de ces ossements :
Dans 200 g d'os
d'un être vivant, il y a 1,0 g de carbone et on mesure 15
désintégrations par minute ; A0 = 15/60 = 0,25
Bq.
A(t)/A0=1,64
10-2 ; A(t) = 1,64 10-2A0=
1,64 10-2 *0,25 =
4,1 10-3 Bq.