La fermentation de 75 L de jus de raisin contenant 240 g de sucre 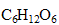 par litre donne de l'alcool éthylique et un dégagement de dioxyde de carbone.
par litre donne de l'alcool éthylique et un dégagement de dioxyde de carbone.
1. Compléter l'équation de la réaction chimique qui modélise la fermentation :
2. Quelle est la quantité de matière maximale d'éthanol obtenue ? C : 12 ; H : 1,0 ; O : 16 g/mol
Masse de sucre : 240*75 = 18000 g =
kg
Masse molaire du sucre : 6*12+12+6*16 = 180 g/mol
Quantité de matière de sucre (mol) = masse (g)
par la masse molaire (g/mol)
n(sucre) = 18000/180 = 100 mol
D'après les coefficients stoechiomètriques, la quantité de matière (mol) d'alcool est égale à deux fois la quantité de matière (mol) de sucre.
n(alcool) = 2*100 = 200 mol
3. Quel est le volume de dioxyde de carbone formé. Volume molaire = 24 L/mol.
D'après les coefficients stoechiomètriques, la quantité de matière (mol) d'alcool est égale à la quantité de matière (mol) de dioxyde de carbone.
n(CO2) = 200 mol
volume d'un gaz (L) = quantité de matière (mol) fois volume molaire (L/mol)
V= 200*24 = 4800 L =
mètres cubes.
4. Quel est le degré alcoolique du vin ? Le degré alcoolique est le nombre de millilitres d'éthanol pur pour 100 mL de vin.
Masse volumique de l'éthanol : 0,740 g/ mL
Masse molaire (g/mol) éthanol : 2*12+6+16 = 46 g/mol
masse d'éthanol (g) = quantité de matière (mol) fois masse molaire (g/mol)
m= 200*46 = 9200 g
volume d'alcool (L) = masse (g)
par la masse volumique ( g/ mL)
V= 9200 / 0,74 = 12432 mL
Si le volume de la solution ne change pas au cours de la fermentation :
volume d'alcool par litre de vin : 12432 / 75 = 166 mL
soit 16,6 mL d'éthanol dans 100 mL de vin ou
°.
.