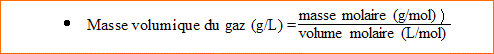1. Calculer la masse de 1,00 m3 d'un gaz de densité d= 1,50. Masse de 1 L d'air : 29,0 g

Masse de 1 L de ce gaz : 29*1,5 = 43,5 g
1m3 = 1000 L
Masse de 1000 L de ce gaz : kg.
2. Calculer la masse de 0,50 L d'un liquide de densité 1,2. Masse de 1 L d'eau : 1,0 kg.

masse de 1 L de ce liquide : 1,2 kg
masse de 0,5 L : 1,2*0,5 = kg
3. Calculer la masse de sulfate de cuivre (CuSO4) à dissoudre dans 0,50 L d'eau pour obtenir une solution ayant une concentration en ion cuivre II égale à 0,20 mol/L. Cu : 63,5 ; S : 32 ; O : 16 g/mol.
Quantité de matière d'ion cuivre II :

n(Cu2+)= 0,2*0,5= 0,10 mol
Or : 
d'où n(CuSO4) = 0,10 mol
Masse molaire du sulfate de cuivre : M=63,5 +32+4*16 = 159,5 g/mol.
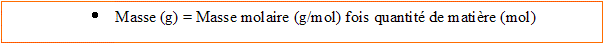
m= 159,5*0,1 = g
4. Calculer le pourcentage massique d'oxygène dans l'hydroxyde de magnésium Mg(OH)2. Mg : 24 ; H : 1,0 ; O : 16 g/mol.
Masse molaire M = 24 + 2*(16+1) = 58 g/mol
Masse d'élément oxygène dans une mole : 16*2 = 32 g.
Pourcentage massique en élément oxygène : 32/58 *100= %
5. Calculer les quantités de matière d'ion sulfate et d'ion potassium dans 200 mL d'une solution de sulfate de potassium (K2SO4) à 0,010 mol/L en soluté apporté.
Quantité de matière en soluté apporté :

n( K2SO4) = 0,2*0,01 = 0,002 mol = 2 mmol
Or : 
d'où : n( K+) = 2*2 = mmol et n( ion sulfate) = 2,0 mmol.
6. Calculer le volume de 100 g d'un gaz de densité d=0,80. Masse d'un litre d'air : 29 g.
masse de 1 L de gaz (g) = masse de 1 L d'air (g) fois densité du gaz par rapport à l'air
masse de 1 L de gaz (g) =29*0,8 = 23,2 g.
| volume du gaz (L) | masse du gaz (g) |
| 1 | 23,2 |
| V ?? | 100 |
Faire les produits en croix :
V= 100/23,2 =
L.
7. Calculer le volume de 100 g d'un liquide de densité d = 0,800.
| volume du liquide (mL) | masse du liquide (g) |
| 1 | 0,8 |
| V ?? | 100 |
Faire les produits en croix
V= 100/0,8 =
mL.
8. Calculer le volume d'une solution de nitrate de cuivre II de concentration en soluté apporté 0,10 mol/L contenant 1,27 g d'ion cuivre II.
Cu : 63,5 g/mol

n (Cu2+)= 1,27 / 63,5 = 0,02 mol

d'où 0,02 mol de soluté apporté.
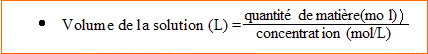
V= 0,02 / 0,1 = 0,20 L =
mL
9. Calculer la masse volumique des gaz suivants : dioxyde de carbone, dichlore, dihydrogène. C : 12 ; O : 16 ; Cl : 35,5 ; H : 1 g/mol. Volume molaire : 24 L/mol.