|
Complexes et précipitation ( concours Centrale 01 ) Les ions de l'aluminium En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||
| .
. |
||
|
||
|
|
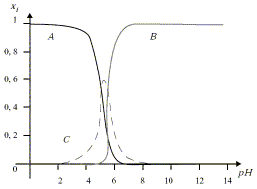
Al3+ + H2O = Al(OH)2+ + H+ ; Ka = 10–5 Al(OH)3(solide) = Al3+ + 3 OH– ; KS = 10–32 Al(OH)3(solide) + OH– = Al(OH)4– ; K= 103 On considère que l'aluminium en solution aqueuse se trouve sous l'une des formes suivantes : Al3+, Al(OH)2+ et Al(OH)4–. On désigne par s la concentration totale de l'aluminium en solution aqueuse en présence du précipité d'hydroxyde d'aluminium et on pose : x1 = [Al3+]/s ; x2 = [Al(OH)2+]/s ; x3 = [Al(OH)4–]/s
Al3+ + H2O = Al(OH)2+ + H+ ; Ka =[Al(OH)2+ ] h / [Al3+] d'où : [Al(OH)2+ ]= Ka [Al3+] / h (1) Al(OH)3(solide) = Al3+ + 3 OH– ; KS =[Al3+][OH–]3. de plus Ke = [OH–] h d'où : [OH–] = Ke/h. KS =[Al3+][OH–]3 = [Al3+] Ke3/ h3 d'où : [Al3+] = KSh3 / Ke3 (2) (1) et (2) donnent : [Al(OH)2+ ]= Ka KSh2 / Ke3 (4) Al(OH)3(solide) + OH– = Al(OH)4– ; K= [Al(OH)4–] / [OH–] = [Al(OH)4–] h / Ke d'où : [Al(OH)4–]= K Ke /h (3) s = KSh3 / Ke3 + Ka KSh2 / Ke3 + K Ke /h. x1 = [Al3+]/s = KSh3 / Ke3 / [KSh3 / Ke3 + Ka KSh2 / Ke3 + K Ke /h] x1 =1 / [1+ Ka/h +KKe4/(Ksh4)]= 1/[1+10-5/h+10-21/h4] x2 = [Al(OH)2+]/s=Ka KSh2 / Ke3 / [KSh3 / Ke3 + Ka KSh2 / Ke3 + K Ke /h] x2 = 1/[ h/Ka+1 + KKe4 /(Ka KSh3 )] =1/[105h+1+ 10-16/h3] x3 = [Al(OH)4–]/s = K Ke /h / [KSh3 / Ke3 + Ka KSh2 / Ke3 + K Ke /h] x3 =1/[KKe4KSh4 ) +Ka KSh3 /(KKe4) +1] = 1/[10-85h4+1016/h3 + 1] A graphe correspondant à x1 car Al3+ est prépondérant en milieu acide. B graphe correspondant à x3 car Al(OH)4– est prépondérant en milieu basique. C : graphe correspondant à x2. Le précipité Al(OH)3(solide) apparaît dès que c0>s. En milieu acide Al3+ est prépondérant et s voisin de [Al3+] = KSh3 / Ke3. KSh3 / Ke3 <c0 ; log Ks + 3 log h - 3 log Ke < log c0 ; pKs+3pH-3pKe>-log c0 ; 3pH >3pKe -log c0 - pKs ; pH > pKe -(log c0 + pKs) /3 à la limite : pH1 = 14 -( log 0,5 +32)/3 = 3,4. ( h= 4 10-4 mol/L) L'approximation faîte est-elle justifiée ? x1 = 1/[1+10-5/h+10-21/h4] voisin de 1/1,025 = 1 x2 = 1/[105h + 1 + 10-16/h3] voisin de 1 / 41 = 0,024 négligeable devant x1. x3 = 1/[10-85h4+1016/h3 + 1] voisin de 1/(6,4 105) = 0 L'approximation est donc acceptable. A pH fortement basique, Al(OH)4– est prépondérant. c0 = [Al(OH)4–] = K Ke /h h = K Ke /c0 ; log h = log K + log Ke - log c0 ; pH2 = pK+pKe+log c0 = -3+14 + log 0,5 = 10,7.(h= 2 10-11) L'approximation faîte est-elle justifiée ? x1 = 1/[1+10-5/h+10-21/h4] voisin de 0 x2 = 1/[105h + 1 + 10-16/h3] voisin de 0 L'approximation est donc justifiée Lasolubilité s est minimum si la dérivée ds/dh=0. s = KSh3 / Ke3 + Ka KSh2 / Ke3 + K Ke /h. ds/dh = 3 KSh2 / Ke3 + 2Ka KSh / Ke3 -K Ke/h2 = 0 3 KSh4 / Ke3 + 2Ka KSh3 / Ke3 -K Ke=0 3 1010h4 + 2 105h3-10-11 = 0 solution : pH voisin 5,4.( h = 4 10-6 mol/L) Calculons la solubilité s pour cette valeur de pH : s = KSh3 / Ke3 + Ka KSh2 / Ke3 + K Ke /h s = 1010 h3 + 105 h2 + 10-11/h = 6,3 10-7 + 1,6 10-6 + 2,5 10-6 = 4,7 10-6 mol/L si c0 est inférieure à 4,7 10-6 mol/L, le précipité ne se forme pas. |
|
|
|