|
Synthèse du benzoate d'éthyle, titrage acide base, bacS 2007 Antilles |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
Le benzoate d'éthyle est synthétisé à partir de l'acide benzoïque et l'éthanol. Cette transformation est modélisée par la réaction d'équation : C6H5COOH + CH3-CH2OH = C6H5-COO-CH2-CH3 + H2O. Etude de la synthèse :
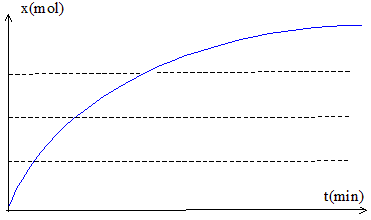
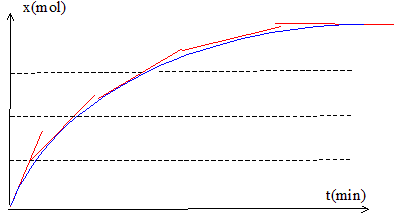
La réaction entre un acide carboxylique et un alcool est une estérification ; cette réaction est lente. (a) et (e) sont donc vraies. Evolution de la vitesse de la réaction étudiée : Expression de la vitesse v = 1/V dx/dt avec V: volume en (L) et x : avancement en mol. dx/dt représente le coefficient directeur de la tangente à la courbe x=f(t) à une date donnée. Or on peut constaté que les tangentes sont de moins en moins inclinées sur l'horizontale au cours du temps : leur coefficient directeur diminue donc. La vitesse étant proportionnelle à ce coefficient, la vitesse diminue au cours du temps.
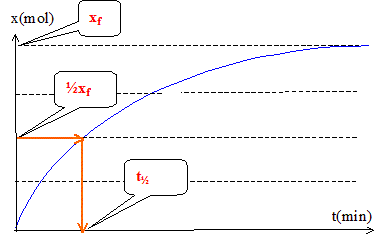
Le temps de demi réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final xf.
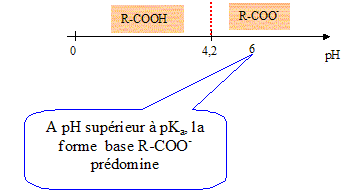
Titrage de l'acide benzoïque restant : L'acide benzoïque C6H5COOH pourra être noté R-COOH ( aq) en solution aqueuse dans la suite de l'exercice.
Equation de la réaction entre l'acide benzoïque et l'eau : RCOOH(aq) +H2O = RCOO-(aq) + H3O+(aq). Expression de la constante d'acidité Ka du couple acide benzoïque / ion benzoate : Ka =[
RCOO-(aq)]éq[H3O+(aq)]éq/
[RCOOH(aq)]éq.
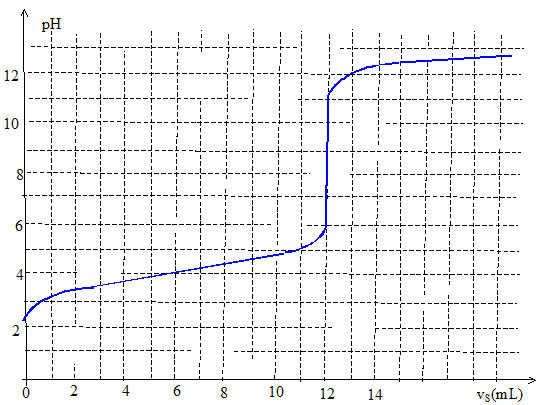
Equation de la réaction support du titrage : RCOOH(aq) + HO-(aq) = RCOO-(aq) + H2O.
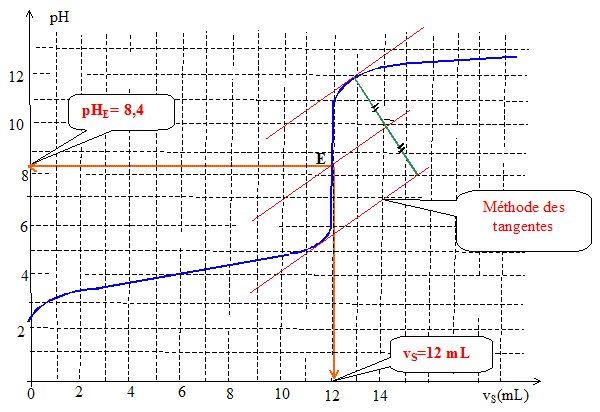
A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. n1(ac) = n(soude) = cS
vS =2,0 10-1 * 12 10-3 =
2,4 10-3 mol. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent. La phénolphtaléine convient.
|
||||||||||||||||||||||||||
|
Rendement de la synthèse : La synthèse du benzoate d'éthyle étudiée précédemment a été réalisée en mélangeant une masse m=1,0 g d'acide benzoïque et un volume v= 10,0 mL d'éthanol
Quantité de matière d'acide benzoïque introduit : n0(ac) = m/M = 1,0 / 122 = 8,2 10-3 mol. Quantité de matière d'éthanol introduit : masse (g) = volume (mL) fois masse volumique ( g/mL) = 10,0 *0,79 = 7,9 g. n0(éth) = m/M = 7,9/46 = 1,7 10-1 mol. Une mole d'acide réagissant avex une mole d'éthanol, ce dernier est en large excès.
Avec n0(ac)-xf = 2,4 10-3 mol et n0(ac) =8,2 10-3 mol d'où xf = (8,2-2,4) 10-3 = 5,8 10-3 mol. Rendement de la réaction : h = xf / xmax avec xmax = n0(ac), l'éthanol est en excès. h =5,8 10-3 /8,2 10-3 = 5,8/8,2 = 0,71 ( 71 %) Pour accélérer la réaction on peut utiliser un catalyseur ( acide sulfurique concentré) ou travailler à température plus élevée ( chauffage à reflux).
|
||||||||||||||||||||||||||
|
|