|
Des esters dans nos cosmétiques, les paraben, dosage acide base, synthèse d'un ester bac S Asie 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
|
|||
|
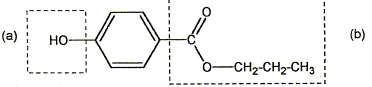
Les cosmétiques sont des produits d'hygiène et d'embellissement du corps humain. Ils sont de plus en plus nombreux dans nos salles de bain. On classe dans les cosmétiques, les produits de soin, de maquillage, de rasage, des produits capillaires, solaires, des parfums... Un cosmétique contient plusieurs ingrédients dont un ou plusieurs principes actifs, un excipient et des additifs. L'emballage d'un produit cosmétique doit comporter la liste complète des ingédients. Dans cet exercice on se propose d'étudier quelques composants des produits cosmétiques. Les parabènes : Les parabènes ( paraben en anglais) sont des conservateurs utilisés dans l'industrie cosmétique pour empécher la prolifération des bactéris et des champignons. On les trouve dans bon nombre de produits de beauté : shampoings, gels douches, crèmeshydratantes....Les parabènes les plus courants sont : le méthylparaben, l'éthylparaben, le propylparaben et le buthylparaben. La formule semi-développée du propylparaben ou parahydroxybenzoate de propyle est :
Les groupes caractéristiques (a) et (b) encadrés dans cette molécule sont : (a) phénol ( groupe -OH hydroxy fixé sur le noyau benzénique) (b) ester. Les réactifs n°1 et n°2 :
Identifions le méthylparaben :
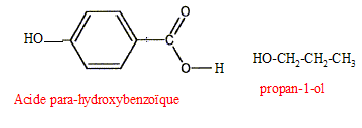
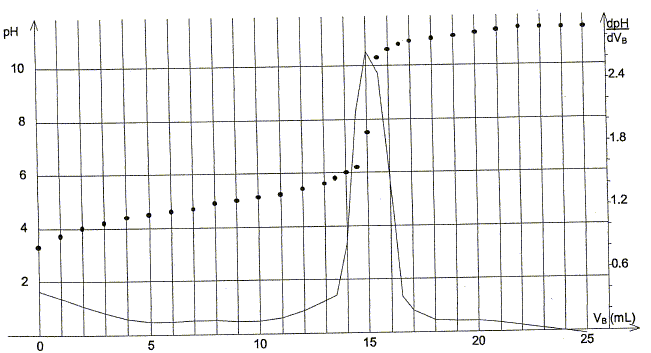
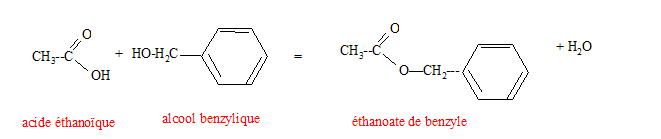
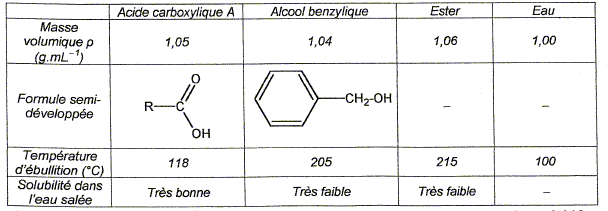
Préparation d'un ester utilisé en parfumerie : Un professeur décide de faire synthétiser à ses élèves un ester utilisé en parfumerie. Chaque binôme dispose d'un flacon A contenant un acide carboxylique noté R-COOH et d'un flacon B contenant l'étiquette alcool benzilique C6H5-CH2OH. A est soit l'acide méthanoïque, soit l'acide éthanoïque, soit l'acide propanoïque. Recherche de l'acide utilisé : Chque binôme dispose d'une solution S obtenue en dissolvant une masse m = 0,90 g d'acide carboxylique A dans une fiole jaugée de 1000 mL les élèves placent dans un becher un volume VA = 10,0 mL de la solution S. Ils placent dans une burette graduée une solution aqueuse d'hydroxyde de sodium ( Na+(aq) + HO-(aq)) de concentration molaire en soluté apporté cB= 1,0 10-2 mol/L et ils réalisent un dosage pH-métrique.
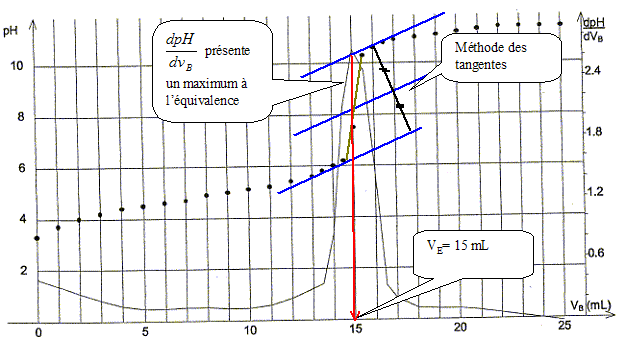
Equation de la réaction support du dosage : R-COOH(aq) + HO-(aq) = R-COO-(aq) + H2O. Volume équivalent VE de ce dosage :
Concentration molaire en soluté apporté cA de la solution S : A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. cAVA = cBVE ; cA= cBVE /VA = 1,0 10-2 * 15/10 ; cA= 1,5 10-2 mol/L. Masse molaire de l'acide carboxylique utilisé pour réaliser la solution S : 1,5 10-2 mol dans 1 l corresponde à 0,90 g de soluté ; 1 mol correspond à 0,90/1,5 10-2 = 90/1,5 = 60 g/mol. L'acide utilisé est l'acide éthanoïque CH3-COOH.
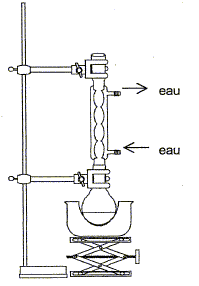
L'estérification est lente, athermique, limitée par l'hydrolyse de l'ester. L'acide sulfurique concentré joue le rôle de catalyseur ; il doit être concentré afin d'apporter le moins d'eau possible : l'eau déplaceraît l'équilibre vers la gauche, hydrolyse de l'ester. Le montage à reflux permet d'augmenter la vitesse de la réaction en travaillant à température modérée ( la température est un facteur cinétique). Il évite les pertes de matière : les
vapeurs se condensent dans le réfrigérant et
retombent dans le milieu
réactionnel.
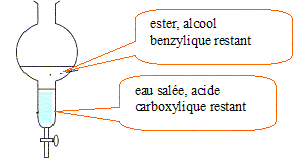
Extraction de l'ester préparé : Au bout d'une heure, on refroidit le mélange réactionnel et on y ajoute 50 mL d'une solution de chlorure de sodium de masse volumique r= 1,20 g/mL. On verse le contenu du ballon dans une ampoule à décanter. On agite et on laisse décanter.
L'ester étant très peu solule dans l'eau salée, se trouve dans la phase organique. La densité de celle-ci, voisine de 1,05, est inférieure à celle de l'eau salée ( 1,20). Dans l'ampoule à décanter la phase la plus dense occupe la partie inférieure.
Rendement de cette synthèse : D'après les nombres stoechiométriques de l'équation, à partir de 2,0 10-1 mol d'alcool et 2,0 10-1 mol d'acide on peut obtenir au mieux 2,0 10-1 mol d'ester. rendement = quantité réelle / quantité théorique = 1,3 / 2 = 0,65 (65 %). On peut améliorer le rendement en utilisant un réactif en excès, ou en éliminant le produit le plus volatil ( l'eau dans ce cas) au fur et à mesure qu'il se forme. On peut aussi remplacer l'acide carboxylique par l'anhydride d'acide correspondante ( anhydride éthanoïque). |
|||
|
|
|||
|
|