|
Titrage potentiométrique du fer dans un produit phytosanitaire bac STL biochimie, génie biologique, 2007 France
|
||||
|
||||
|
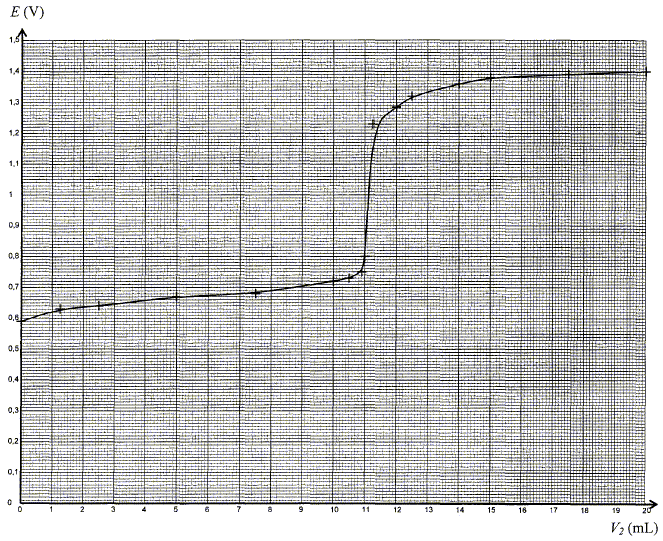
Le sulfate de fer (Fe2+ + SO42- ) constitue le principe actif de nombreuses solutions destinées à combattre la chlorose ferrique des végétaux. Il est utilisé pour revitaliser les gazons. L'étiquette d'une solution commerciale indique qu'elle contient ,6,0 % en masse d'élément fer soit une concentration molaire égale à 1,09 mol/L.
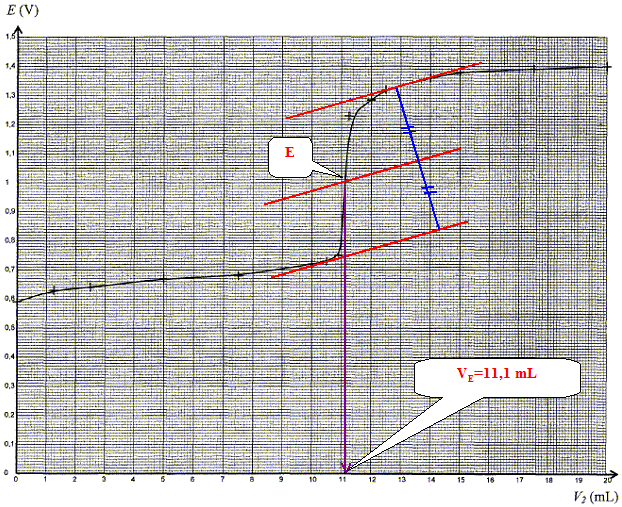
On souhaite déterminer la concentration c1 en ion fer (II) Fe2+ de la solution S' par titrage potentiométrique. Pour cela, on prélève un volume V1 = 10,0 mL de la solution S' dans laquelle on plonge une électrode de mesure et une électrode de référence. La solution titrante utilisée est une solution acidifiée de sulfate de cérium IV (Ce4+ + 2SO42- ) de concentration c2 = 0,100 mol/L. On note V2 le volume de solution titrante versée et E le potentiel de l'électrode de mesure donné par rapport à l'électrode standard à hydrogène.
Réponse : couples oxydant / réducteur : Fe3+ / Fe2+ : Fe2+ = Fe3+ + e- oxydation. Ce4+ / Ce3+ : Ce4+ + e- = Ce3+ réduction. Ce4+ +Fe2+ = Fe3+ + Ce3+. A l'équivalence du titrage les quantités de matière des réactifs mis en présence sont en proportions stoechiomètriques. n(Fe2+) =n(Ce4+ ) n(Ce4+ ) = c2 VE ; n(Fe2+)= c1 V1 ; c1 V1=c2 VE ; c1 =c2 VE /V1. c1 = 0,100*11,1/10,0 = 0,111 mol/L ; c = 10 c1 = 1,11 mol/L. écart relatif : (1,11-1,09 )/ 1,09 = 0,018 ( 1,8 %). En accord avec l'indication de l'étiquette.
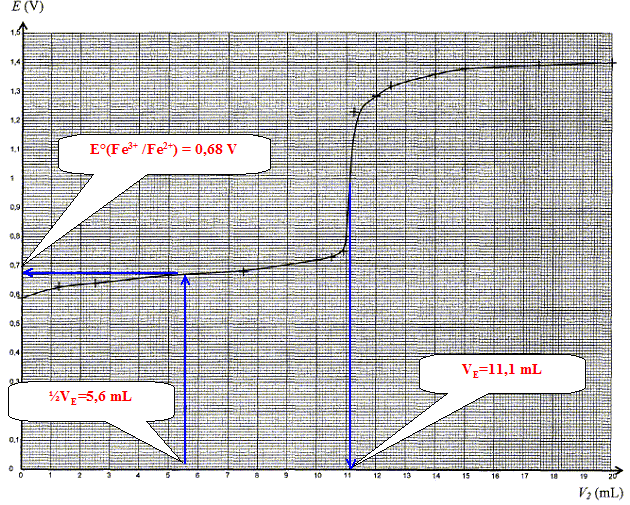
- Ecrire la demi-équation électronique relative au couple Fe3+ / Fe2+ puis donner l'expression littérale du potentiel d'électrode du couple Fe3+ / Fe2+. - Etablir la relation entre les concentrations [Fe2+] et [Fe3+] à la demi équivalence c'est à dire pour V=½VE. - Donner l'expression littérale du potentiel d'électrode du couple Fe3+ / Fe2+ à la demi équivalence. - Déterminer graphiquement la valeur du potentiel standard du couple Fe3+ / Fe2+ et comparer avec la valeur théorique ( 0,68 V). Réponse : Fe2+ = Fe3+ + e- E = E°(Fe3+/Fe2+) + RT/F ln ([Fe3+]/[Fe2+]) Quantité de matière initiale d'ion Fe2+ : n(Fe2+)0= c1 V1 ; c1 V1=c2 VE ; n(Fe2+)0=c2 VE Quantité de matière d'ion Fe2+ restant à la demi équivalence : n(Fe2+)½VE= ½c1 V1 ; n(Fe2+)½VE= ½c2 VE Quand une mole d'ion fer II disparaît, il se forme une mole d'ion fer III. Quantité de matière d'ion Fe3+ formé à la demi équivalence : n(Fe3+)½VE= ½c2 VE = n(Fe2+)½VE. En conséquence ln ([Fe3+]/[Fe2+]) = ln 1 = 0 et le potentiel d'électrode du couple Fe3+ / Fe2+ vaut : E°(Fe3+/Fe2+)
|
||||
|
|
||||
|
|