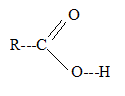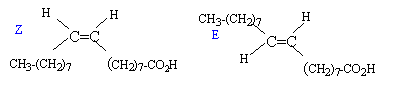|
Bts esthétique 2002 : oléine ; électricité; gaz parfait En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
| .
. |
|||
|
|||
corrigé La méthode VSEPR permet de prévoir la géomètrie d'une molécule à partir du nombre de directions de liaisons et du nombre de doublets non liants de l'atome central. Les doublets liants et non liants se repoussent et se disposent le plus loin possible les uns des autres. Le carbone du groupe acide carboxylique possède 3 directions de liaisons et aucun doublet non liant : d'où le type AX3.
Dans l'hypothèse d'une chaîne carbonée saturée, à partir de 17 atomes de carbone, on s'attend à 17*2+1 = 35 atomes d'hydrogène. Or la chaîne C17H33- ne compte que 33 atomes d'hydrogène : celle-ci est insatuére ( présence d'une double liaison >C=C< ) L'acide oléique présente une isomérie de type Z E : diastéréoisomérie.
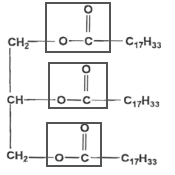
La molécule d'oléine, écrite ci-dessous compte trois fonctions ester.
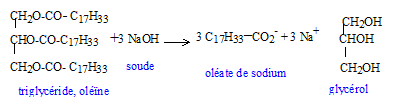
équation de la réaction d'addition du diiode sur l'oléine : C57 H104 O 6 + 3I2 = C57 H104 O 6 I6. Indice d'iode de l'oléine : Le diiode se fixe sur les liaisons doubles carbone carbone ; l'oléine possède ce genre de liaisons ( 3 par molécule) Une mole d'oléine peut donc fixer 3 moles de diiode I2. oléine : C57 H104 O 6 soit 884 g/mol ; diiode : (127+127 ) = 254 g/mol n( oléine) = 35/884 mole ; n(I2 ) = 3 n(oléine) = 3 *35/884 =0,119 mol indice d'iode : 3*254*35/884 = 30,2 saponification, lente mais totale :
glycérol ou propan-1,2,3 triol. savon obtenu : oléate de sodium ; un savon est amphipile ( il possède une extrémité hydrophile -COO- et une longue chaîne carbonée lipophile ) masse de savon théoriquement obtenu : n (oléine ) = 265,2 / 884 = 0,3 mol ; n(savon) = 3*0,3 = 0,9 mol M( savon) =12*178+33+32+23=304 g/mol m = nM = 0,9*304 =273,6 g.
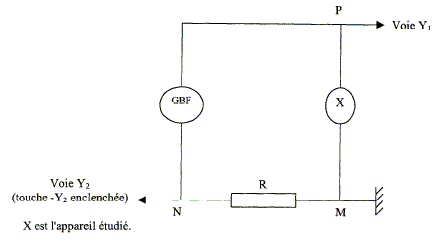
Aux bornes d'un gBF, on branche en série une résistance R= 10 W et un appareil électrique noté X utilisé en esthétique. On visualise deux tensions sur un oscilloscope. La touche -Y2 est enclenchée et permet d'observer la tension -uNM = uMN.
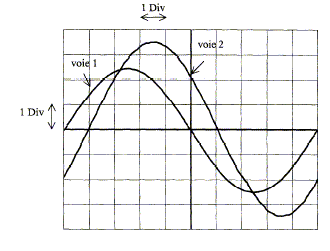
corrigé On visualise sur la voie Y2 une tension proportionnelle à l'intensité du courant. période T = 10 divisions soit 10*2 = 20 ms = 0,02 s ; fréquence : f=1/T = 1/0,02 = 50 Hz ; pulsation w = 2pf = 6,28*50 = 314 rad/s. La différence de phase entre la tension aux bornes de l'appareil X et l'intensité du courant correspond à une division soit 0,1 période soit j = 360*0,1 = 36 ° = 0,2 p rad. La tension aux bornes de X ( voie 1) est en avance sur l'intensité ( voie 2) : l'appareil X est donc inductif. Le facteur de puissance est cosj = cos 36 = 0,81. intensité maximale : voie 2 UNM max = 3,5*2 = 7 V R= 10 W d'où Imax = 7/10 = 0,7 A. intensité efficace : Ieff = Imax / 1,414 = 0,5 A. impédance Z de X : voie 1 Umax = 2,5*5 = 12,5 V Z = Umax / Imax =12,5/0,7 = 17,8 W. puissance moyenne consommée par X : P = Ueff Ieff cos j avec Ueff = 12,5 / 1,414 = 8,84 V P = 8,84*0,5*0,81 = 3,6 W. puissance apparente : S = Ueff Ieff = 8,84*0,5 = 4,4 VA. |
|||
corrigé
n = 4,00 105 * 2 10-4 (8,32 *293) = 3,28 10-2 mol. nouvelle pression du diazote : T = 273+50 = 323 K P = nRT/V = 3,28 10-2 *8,32*323/2 10-4 =4,4 105 Pa. |
|||
|
|