|
Concours ca/plp : synthèses organiques d'un ester 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Un groupe d'élèves décide de réaliser et de suivre des synthèses organiques, celle d'un ester E de formule HCOO-C2H5 et d'un ester M.
I. L'ester E :
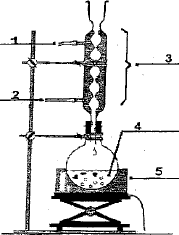
Les élèves trouvent que la synthèse nécessite un alcool A et un réactif B. le protocole suggère de réaliser un montage à reflux puis d'introduire dans le ballon 31 mL d'alcool A, 20 mL du produit B ainsi que quelques gouttes d'acide sulfurique concentré et quelques grains de pierre ponce. Les livres stipulent que le rendement est de 67 % après relargage.
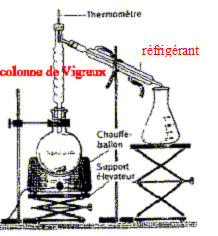
Dans un manuel, on propose la synthèse de l'ester M en utilisant un montage de distillation fractionnée. De l'acide méthanoïque, du méthanol et toujours quelques gouttes d'acide sulfurique concentré sont introduits dans le réacteur. Ce dispositif permet d'obtenir un rendement proche de 100 %.
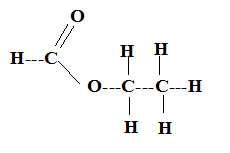
I. L'ester E : Formule développée de l'ester E.
Son nom en nomenclature systématique : méthanoate d'éthyle. Masse molaire de cet ester : M= 3*12+2*16+6=74 g/mol. Dans le commerce spécialisé, on trouve des flacons de 50 ml de l'ester E. Quantité de matière contenue dans le flacon : masse (g) = masse volumique (g/mL) * volume (mL) = 0,91*50 = 45,5 g. quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 45,5 / 74 =0,6149 mol ( 0,61 mol). II. Synthèse de l'ester E : Les élèves trouvent que la synthèse nécessite un alcool A et un réactif B. le protocole suggère de réaliser un montage à reflux puis d'introduire dans le ballon 31 mL d'alcool A, 20 mL du produit B ainsi que quelques gouttes d'acide sulfurique concentré et quelques grains de pierre ponce. Les livres stipulent que le rendement est de 67 % après relargage. Nom de l'alcool A : éthanol CH3-CH2OH. Formule développée du réactif B : acide méthanoïque
Equation associée à la réaction d'estérification : CH3-CH2OH + Les propriétés caractéristiques de cette réaction d'estérification : lente, athermique, limitée par l'hydrolyse de l'ester. Schéma annoté du montage à réaliser :
L'acide sulfurique joue le rôle de catalyseur. La pierre ponce régularise l'ébullition lors du chauffage à reflux. Tableau d'avancement pour cette réaction : quantités de matière initiales : masse (g) = masse volumique (g/mL) * volume (mL) acide méthanoïque : m = 1,22*20 = 24,4 g ; alcool éthylique : 31*0,79 = 24,5 g quantité de matière (mol) = masse (g) / masse molaire (g/mol) acide méthanoïque : 24,4 / 46=0,53 mol ; éthanol : 24,5/46 = 0,53 mol.
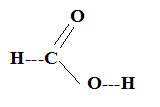
Masse d'ester théorique : xmax M(ester) = 0,53*74 = 39,2 g ( 39 g). Technique pour extraire l'ester E en fin de réaction : décantation, l'ester peu soluble dans l'eau et moins dense que la phase aqueuse occupe la partie supérieure. En modifiant les quantités initiales de réactifs, ( excès de l'un des réactifs) on peut espérer améliorer le rendement. Interêt de chauffer pour réaliser cette transformation chimique : on augmente la vitesse de la réactin ( la température est un facteur cinétique). Equation associée à une autre réaction permettant d'obtenir un rendement de 100 % lors de la synthèse de E : Remplacer l'acide méthanoïque par l'anhydride méthanoïque (HCO)2O ou par le chlorure de méthanoyle HCOCl. (HCO)2O + CH3-CH2OH -->HCOOC2H5 + HCOOH HCOCl +
CH3-CH2OH
-->HCOOC2H5 +
HCl.
III. Amélioration du rendement : La lettre "R" correspond aux risques présentés par le méthanol. La lettre "S" correspond aux mesures de sécurité à mettre en oeuvre. Schéma annoté du montage de distillation fractionnée :
Composition des premières gouttes récupérées au cours de la distillation : espèce la plus volatile, l'ester M ( Tébullition = 31,5°C) La température en tête de colonne est 31,5°C. La température reste constante tant que la nature du produit qui s'écoule ne change pas. On détermine expérimentalement la fin de la réaction lorsque la température s'élève. Un tel dispositif expérimental permet d'améliorer le rendement d'une réaction d'estérification ( éliminer l'ester ou l'eau au fur et à mesure où il se forme) dans la mesure où l'ester ou bien l'eau sont plus volatils que les ractifs. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|