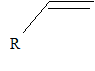|
Spectroscopie I R, polymérisation concours police scientifique 2005 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
Scellé n°1 : plaque minéralogique arrière 111 AAA 75 en matière plastique, avec au dos des rubans adhésifs double face blanc toilé. Scellé n°2 : plaque minéralogique avant 111 AAA 75 en matière plastique, avec au dos des rubans adhésifs double face blanc toilé. Scellé n°3: plaque minéralogique métal 222 AAA 75 avec au dos des rubans adhésifs double face blanc. L'examen permet de distinguer deux types : - Bandes adhésives doubles faces armés de fils transversaux ( scellés n°1 et n°2) - Bandes adhésives double face simples ( scellé n°3 ). Les adhésifs étant constitués de polymères, ceux-ci sont identifiés par spectroscopie infrarouge à transformée de Fourier. Les spectres IR obtenus sont ensuite comparés à ceux de la banque de données des polymères. Echantillonnage : Les rubans armés sont préalablement trempés dans un solvant organique, le trichloéthylène, afin de s'affranchir de leur composante adhésive. Cette opération permet d'isoler les fils utilisés dans leur armature. Le même procédé de séparation est utilisé sur les adhésifs lisses afin d'isoler le support plastique. Les résultats de cette analyse sont donnés ci-dessous :
Les rubans adhésifs double face armés des scellés n°1, 2 et 3 sont identiques.
Quels sont les critères de choix d'un solvant ? Le solvant doit être liquide à la température et à la pression où l'extraction. est pratiquée. Le solvant ne doit pas être miscible à la phase contenant initialement le composé à extraire. Le composé à extraire doit être beaucoup plus soluble dans le solvant que dans le milieu initial.
La Spectroscopie Infrarouge à Transformée de Fourier (FTIR) est basée sur l'absorption d'un rayonnement infrarouge par le matériau analysé. Elle permet via la détection des vibrations caractéristiques des liaisons chimiques entre deux atomes d'effectuer l'analyse des fonctions chimiques. La spectrométrie IRTF est basée sur l'obtention dans le domaine temporel d'un interférogramme à l'aide d'un interféromètre de Michelson. Le spectre désiré est ensuite obtenu par transformée de Fourier de cet interférogramme.
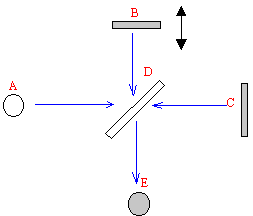
L'interféromètre de Michelson est constitué de deux miroirs B et C, d'une lame séparatrice semi-transparente D. A est la source lumineuse et E le plan d'observation ( détecteur) L'échantillon doit être placé entre l'un des miroirs et la lame D. La source A est un filament incandescent émettant sur tout le spectre infrarouge. La radiation émise est divisée en deux faisceaux ( référence et échantillon) par la lame séparatrice D. Quelles informations peut-on obtenir ? La partie droite du spectre ( <1500 cm-1) ou empreinte digitale comprend un grand nombre de bandes de forme variée. Si deux spectres présentent, dans cette région, les mêmes bandes ( position et intensité relative), on peut conclure à l'identié des deux composés. Mais le grand nombre de bandes rend l'analyse compliquée ; cette région apporte peu d'information structurelle. Dans la partie gauche ( >1500 cm-1) on trouve les bandes caratéristiques des groupes fonctionnels C=O, O-H, N-H, C=C. Techniques d'échantillonnage : - Les liquides et les solides peuvent être mis en solution dans un solvant contenu dans une cellule ( bonne résolution des bandes, mais le solvant peut interférer). - Les liquides peuvent être mis sous forme de film entre deux pastilles de NaCl ( bandes élargies, simple à mettre en oeuvre, absence de solvant). - Solides mis dans des pastilles de KBr ( plus compliqué à mettre en oeuvre, absence de solvant)
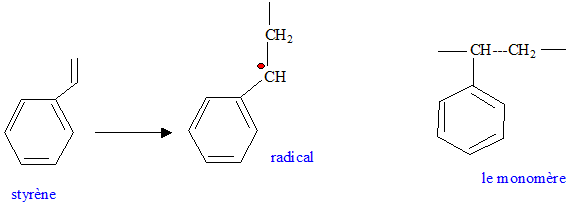
radicalaire.
Quelles autres voies de polymérisation connaissez-vous ? Les polymérisations anioniques et les polymérisations cationiques. Les solvants utilisés sont polaires. Le monomère est du type R doit être attracteur, afin de stabiliser l'anion ( polymérisation anionique). L'amorceur est une base ( buthyllihtien BuLi) R doit être donneur, afin de stabiliser le cation ( polymérisation cationique) L'amorceur est un acide de Lewis TiCl4, BF3 auquel on ajoute un acide fort. |
||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
|