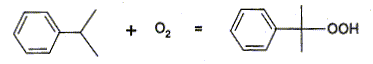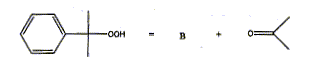L'acétone CH3-CO-CH3
est un solvant très utilisé dans l'industrie
et au laboratoire. C'est également un composé
à la base de fabrication de plastiques, de
médicaments, et d'autres produits chimiques.
- Quel est le nom de l'acétone dans la
nomenclature officielle ?
- Donner la formule développée et le nom
d'un isomère de l'acétone possédant
le même groupe fonctionnel.
- Voici un extrait de la fiche internationale de
sécurité de l'acétone :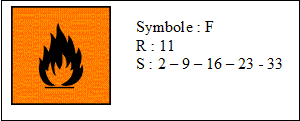
Quels types de renseignements sont donnés par les
phrases R et S ?
réponse :
R : phrases de
risques :
facilement inflammable.
S : phrases de
sécurité,
conseils de prudence : conserver dans un endroit
ventilé, hors de portée des enfants, loin
de toutes flammes, ne pas respirer.
Préparation de l'acétone, le
procédé au cumène :
Il s'agit d'un procédé industriel qui
permet d'obtenir l'acétone et un autre produit B.
Cette méthode comporte trois étapes.
Etape 1 :
On fait réagir le propène gazeux sur du
benzène en présence d'acide phosphorique
H3PO4 sur un support de silice
à une température de 250°C sous une
pression de 20 bar. On obtient alors le cumène
C9H12 (liq).

A cette température l'enthalpie standart de cette
réaction est DrH°
= -113 kJ /mol.
- Cette réaction est-elle exothermique ou
endothermique ? Justifier.
- Quel est l'effet d'une augmentation de la
température sur la cinétique de cette
transformation, le rendement de la synthèse ?
réponse :
DrH° est
négatif : le système libère de
l'énergie dans le milieu extérieur , la
réaction est
exothermique.
La température est un facteur cinétique : une
augmentation de la température augmente la vitesse de
la réaction.
En augmentant la température d'une réaction
exothermique, on déplace l'équilibre dans le
sens indirect : le rendement de la synthèse va
diminuer.
Etape 2
:
- Une solution aqueuse de carbonate de sodium
est alors additionnée au cumène afin
d'obtenir un pH voisin de 9. Le cumène est alors
oxydé par l'air à une température de
° C. On obtient l'hydroperoxyde de cumyle
:
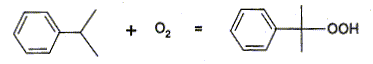
Ecrire l'équation de la réaction de l'ion
carbonate avec l'eau. Expliquer pourquoi l'ion carbonate est
une base et nommer son acide conjugué.
réponse :
CO32-(aq)
+ H2O(l) = HCO3- (aq) +
HO-(aq)
L'ion CO32-(aq) est susceptible de
gagner un proton : c'est une base au sens de
Brönsted.
L'acide conjugué de l'ion carbonate est l'ion
hydrogénocarbonate
HCO3- (aq) ou
bicarbonate.
|