|
Agrégation 2006 : la molécule de dioxygène ; diagramme binaire O2-N2. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
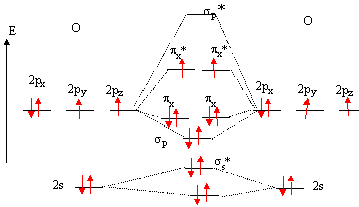
Configuration électronique fondamentale de l'oygène : Z=8 soit 1s2, 2s2, 2p4. Règles d'élaboration des diagrammes moléculaires : Les orbitale atomiques de même symétrie et d'énergie proche sont combinées. Il en résulte un nombre d'orbitale moléculaire (OM) égal au nombre d'orbitale atomique ( OA) de départ. * placer les OA des deux atomes de part et d'autre d'un espace destiné au tracé des OM. Si deux atomes ne sont pas identiques, les OA n'ont pas la même énergie : l'atome le plus électronégatif est celui dont les OA sont situées le plus bas. * connaître les liaisons :
* trouver les positions des OM par rapport aux OA :
Diagramme d'orbitales moléculaires de la molécule O2 :
Règles à respecter pour placer les électrons sur ce diagramme : Placer les électrons dans les niveaux de plus basse énergie. Remplir le maximum d'orbitales dégénérées avec un électron, puis constituer des doublets. propriétés
paramagnétiques de O2 : deux
électrons non appariés sont présents
d'après ce diagramme.
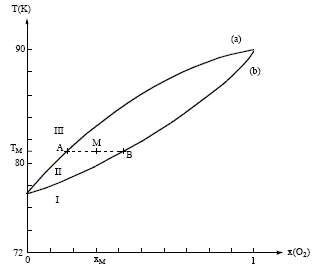
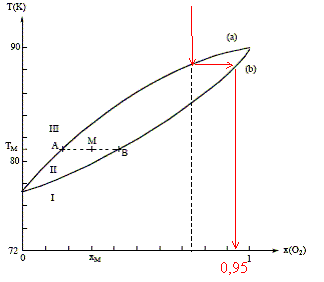
Distillation fractionnée de l'air liquide : Le changement d'état des mélanges binaires O2 - N2 s'étudie grâce au diagramme isobare ( P= 1 bar) d'équilibre liquide-vapeur suivant :
Mélanges binaires idéaux : Microscopiquement la solution se comporte comme un liquide pur : les interactions entre molécules différentes et molécules identiques sont égales. Il faut pour cela que les molécules soient assez semblables ( exemple O2 et N2). On observe un diagramme en fuseau ou diagramme isotherme idéal pour des liquides totalement miscibles. Phases en présence dans les domaines I, II, III : à pression constante, quand la température s'élève, on passe de l'état liquide à l'état vapeur. donc : I : liquide ; II : liquide et vapeur en équilibre ; III : vapeur courbe a : courbe de rosée, ensemble des points où apparaît la première goutte de liquide lorsqu'on refroidit de la vapeur. courbe b : courbe de
d'ébullition, ensemble des points où
apparaît la première goutte de vapeur lorsqu'on
chauffe le liquide.
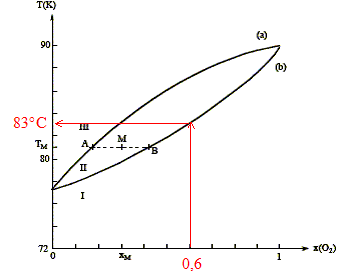
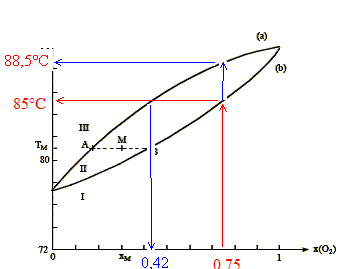
On considère n moles d'un mélange de composition xM, porté à la température TM. Le point M à l'intérieur du fuseau indique que nous sommes en présence du mélange liquide + vapeur ; il nous renseigne aussi sur les proportions respectives du liquide et de la vapeur. notations : xL fraction molaire de O2 à l'état liquide ; xV fraction molaire de O2 à l'état vapeur ; xM fraction molaire en O2. nL : nombre de moles de mélange à l'état liquide ; nV : nombre de moles de mélange à l'état vapeur. nL + nV = n (1) La conservation du dioxygène s'écrit : nL(O2) + nV(O2)= n(O2). soit xLnL + xV nV = xM n (2) (1) et (2) donne : xLnL + xV (n-nL)= xM n nL(xL-xV) = n(xM-xV) ; nLAB = n AM. Rectification de l'air liquide :
|
|||||||
|
|
|||||||
|
|