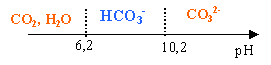|
acide base : ion hydrogénocarbonate ; pile ; ester. diplôme d'accès aux études universitaires option B 2003 ( durée : 2 heures) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
Problème 1 : ion hydrogénocarbonate : ( 7 points ) Le calcaire et le tartre contiennent essentiellement du carbonate de calcium CaCO3. Dans une eau calcaire chargée en dioxyde de carbone, il se passe une réaction dont la constante d'équilibre vaut K=103,9. L'équation de cette réaction est : CO32-(aq) + CO2, H2O=2HCO3-(aq)
CO2, H2O+H2O= HCO3- +H3O+ : Ka1 =[HCO3-][H3O+] / [CO2, H2O]= 10-6,4 ; HCO3- +H2O= CO32- +H3O+ : Ka2 =[H3O+][CO32-] / [HCO3-]= 10-10,3. CO32-(aq) + CO2, H2O=2HCO3-(aq) : K= [HCO3-]2 / ([CO32-][CO2, H2O]) K= Ka1 /Ka2 =10-6,4 /10-10,3=103,9. Domaine de prédominance des espèces acides et basiques des deux couples de l'ion hydrogénocarbonate :
Titrage des ions d'une eau minérale : On réalise le titrage d'une eau minérale
pour connaître sa concentration en ions
HCO3-. Un volume V1 = 20 mL
de cette eau minérale est titré par une
solution d'acide chlorhydrique de concentration molaire
CA= 0,010 mol/L. La courbe de titrage montre
qu'au point d'équivalence, le volume d'acide
ajouté est VA= 13 mL et le pH est de
5,7. à l'équivalence les quantité de matière des réactifs sont en proportions stoechiométriques : V1[HCO3-] =CAVA ; [HCO3-] =CAVA /V1 = 0,1*13/20 = 6,5 10-3 mol/L
Problème 2 :pile : ( 7 points ) On réalise une pile qui met en oeuvre les couples Al3+ /Al et Fe2+/Fe. Les électrodes sont placées dans des solutions de volume V=60 mL et où les concentrations des ions valent toutes les deux c=0,5 mol/L. On donne la constante d'équilibre pour la réaction entre les ions Fe2+ et Al : K= 1,0 10122.
Le réducteur le plus fort s'oxyde : 2Al =2Al3+ + 6e-. L'aluminium constitue la borne néagtive de la pile. L'oxydant le plus fort se réduit : 3Fe2++ 6e- =3Fe. Bilan : 2Al +3Fe2+ =2Al3+ +3Fe. Qr i = [Al3+]2/[Fe2+]3 = c2 / c3 = 1/c = 1/0,5 = 2 Qr i < K : le système évolue dans le sens direct. Tableau d'avancement de la transformation :
xmax = 0,01 mol masse minimale de métal Al : a=2xmax = 0,02 mol masse = a MAl = 0,02*27 = 0,54 g. Durée pendant laquelle la pile peut débiter une intensité de 60 mA : Fe2++ 2e- =Fe. d'où n(e-) = 2 n(Fe2+) = 2*0,01 = 0,02 mol Quantité d'électricité : Q= 96500*0,02 = 1930 C Q= IDt avec I= 0,06 A soit D t = Q/I =1930/0,06 = 3,2 104 s.
Problème 3 : nitrates : ( 6 points ) On hydrolyse une masse m = 22,5 g d'un ester E. En fin de réaction, on obtient un mélange d'acide éthanoïque noté A et de propan-1-ol noté P. Après séparation, on obtient une masse m' = 2,70 g d'acide éthanoïque.
CH3-COO-CH2-CH2-CH3 + H2O = CH3-COOH + HOCH2-CH2-CH3 éthanoate de propyle + eau = acide éthanoïque + propan-1-ol ( alcool primaire) rendement : masse réelle d'acide obtenue / masse théorique d'acide. Mester = 5*12+10+2*16 = 102 g/mol ; n(ester) = m/Mester = 22,5 / 102 = 0,22 mol d'ester On peut obtenir au plus 0,22 mol d'acide éthanoïque. M (acide éthanoïque )= 2*12+4+2*16 = 60 g/mol masse théorique d'acide = 0,22*60 = 13,2 g rendement : 2,7/13,2 = 0,20. |
|||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
|