|
Détermination du pKa du bleu de bromophénol : spectrophotométrie bac S Liban 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On prépare dans une fiole jaugée, deux litres d'une solution mère S0 de bleu de bromothymol de concentration molaire en soluté apporté c0 =3,0 10-5 mol/L. Première partie : étude de la solution mère. On considère un volume V= 100 mL de solution S0 dont le pH est 4,7. Calculer la quantité de matière de bleu de bromophénol n0 initialement introduite dans 100 mL de solution S0. n0 = c0 V = 3,0 10-5*0,1 = 3,0 10-6 mol. L'espèce HIn est un acide. Donner la définition d'un acide selon Bronsted. Espèce, ion ou molécule susceptible de céder un proton H+. HInaq +
H2O(l) = In-aq +
H3O+aq. Identifier les couples
acide /
base. H3O+aq
/H2O(l) et HInaq /
In-aq.
On prépare deux solutions à partir de la solution mère S0. Préparation de la solution S1. A 1 L de solution S0 on ajoute 0,010 mol d'ion oxonium H3O+ en utilisant de l'acide chlorhydrique concentré. Cette addition se fait sans variation appréciable de volume de la solution. La solution obtenue est jaune, de pH=2, de concentration molaire en bleu de bromophénol apporté c0 = 3,0 10-5 mol/L. Préparation de la solution S2. 1 L de solution S0 on ajoute 0,010 mol d'ion hydroxyde HO- en utilisant de l'hydroxyde de sodium concentré. Cette addition se fait sans variation appréciable de volume de la solution. La solution obtenue est bleue, de pH=12,0, de concentration molaire en bleu de bromophénol apporté c0 = 3,0 10-5 mol/L. Pour les deux solutions on admet la relation : [HIn] + [In-] = c0. Quelle espèce chimique du couple de l'indicateur coloré prédomine sans la solution S1 ? dans la solution S2 ? Dans la solution S1 la couleur jaune indique la prédominance de la forme acide HIn. Dans la solution S2 la couleur bleue indique la prédominance de la forme base In-. De quel paramètre dépend la proportion d'acide et de base conjuguée dans chaque solution ? du pH de la solution. Pour la solution S2 on émet l'hypothèse que la concentration effective de la forme acide est négligeable. Quelle est alors la valeur de la concentration effective de la forme basique In- ? [HIn] + [In-] = c0. [HIn] ~ 0 d'où [In-] ~ c0.
Troisième partie : spectrophotométrie. Dans un becher contenant un volume quelconque de la solution S1, on ajoute de la solution S2 de façon à obtenir successivement des solutions dont les pH sont donnés dans le tableau ci-dessous. A la longueur d'onde
l
utilisée par le spectrophotomètre, seule la
forme basique In- absorbe. - la concentration molaire en bleu de bromophénol apporté est c0 =3,0 10-5 mol/L. - [HIn] + [In-] = c0. On rappelle que l'absorbance A d'une solution est liée à la concentration [X] en espèce absorbante par : A = k [X] où k est une constante. Montrer que l'absorbance A d'un mélange quelconque est donnée par : A= k[In-]. " A la longueur d'onde l utilisée par le spectrophotomètre, seule la forme basique In- absorbe". L'absorbance A d'une solution est liée à la concentration [X] en espèce absorbante donc A= k[In-]. Pour la solution S2 de pH=12, l'absorbance est maximale. Montrer que l'absorbance maximale Amax et la concentration molaire en bleu de bromophénol apporté c0 vérifient la relation Amax = k c0. En déduire la valeur du coefficient k et son unité. D'une part A= k[In-] et d'autre part dans la solution S2, [In-] ~ c0 : donc Amax = k c0. k = Amax / c0 = 1,33 / 3,0 10-5 =5,53 104~ 5,5 104 L mol-1. ( A est sans dimension et c0 est en mol/L) Calculer les concentrations effectives des espèce HIn et In- présentes dans le mélange lorsque A = 0,83. [In-] =A/k = 0,83 / 5,53 104 =1,5 10-5 mol/L. [HIn] = c0-[In-] = 3,5 10-5 - 1,5 10-5 =1,5 10-5 mol/L.
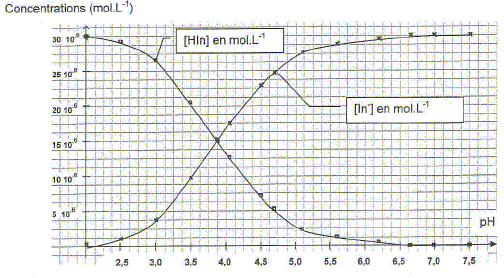
L'exploitation des données expérimentales a permis de construire le diagramme suivant :
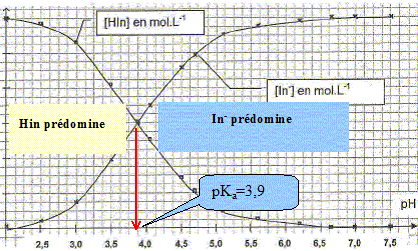
Déterminer à partir de ce graphique les domaines de prédominance des formes acide et basique du bleu de bromophénol. A pH <3,9 la forme HIn prédomine ; à pH >3,9 la forme In- prédomine. Donner la relation entre pH, pKa, [HIn] et [In-]. pH= pKa + log ( [In-] / [HIn] ). En déduire qu'un point particulier de ce graphique permet de déterminer le pKa du couple étudié. Donner sa valeur. A l'intersection des deux courbes, [HIn] = [In-] et en conséquence pH= pKa = 3,9.
Vérifier par un calcul que l'hypothèse émise " dans la solution S2 HIn est négligeable" est légitime. pH= pKa + log ( [In-] / [HIn] ). [In-] / [HIn] = 10pH-pKa. avec pH=12 et pKa = 3,9 ; pH-pKa = 8,1 ; [In-] / [HIn] = 108,1 =1,2 108. [HIn] ~ 10-8 [In-] ; donc HIn est négligeable devant In-.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|