|
Diagramme E pH du chlore ; électrolyse d'une solution de chlorure de sodium capes agricole 2004 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
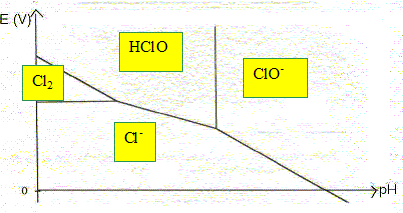
Cl2 (aq), Cl-(aq), HClO (aq), ClO- (aq).
La convention adoptée pour ce tracé est la suivante : sur la frontière entre deux espèces, les concentrations des deux espèces en solution sont, chacune, égales à 0,10 mol.L-1. Compléter le diagramme donné en indiquant les domaines de prédominance des espèces considérées.
Déterminer l’abscisse de la frontière entre les deux espèces HClO(aq) et ClO-(aq). Donnée : couple acide base HClO / ClO- : pKa = 7,5 HClO + H2O = ClO- + H3O+ .... Ka =[H3O+ ][ClO-] / [HClO] Sur la frontière : [ClO-] = [HClO] d'où Ka =[H3O+ ] soit pH=pKa = 7,5.
E°
(Cl2(aq) /Cl-(aq)) = 1,39
V Cl2(aq) +
2e- = 2 Cl-(aq)) E1 =E°
(Cl2(aq) /Cl-(aq)) + 0,03 log
([Cl2(aq)]
/[Cl-(aq)]2) ;
Sur la frontière :
[Cl2(aq)]=[Cl-(aq)]
d'où : E1 =E°
(Cl2(aq) /Cl-(aq)) + 0,03 log
(1
/[Cl-(aq)])=
1,39 +0,03 log10
=1,42
V. E° ( HClO(aq) /Cl2(aq)) = 1,60 V 2HClO(aq) + 2e- + 2H+ = Cl2(aq) + 2H2O E2 =E° ( HClO(aq) /Cl2(aq)) + 0,03 log ([HClO(aq) ]2[H+]2 /[Cl2(aq)]) Sur la frontière : [Cl2(aq)]=[HClO(aq) ] d'où : E2 =E° ( HClO(aq) /Cl2(aq)) + 0,03 log ([HClO(aq) ][H+]2 ) E2 =E° ( HClO(aq) /Cl2(aq)) + 0,03 log 0,1 + 0,06 log [H+] E2 =1,57- 0,06 pH ; pente -0,06 pH. Élaborer et reporter sur le diagramme potentiel – pH de l’eau en prenant les pressions partielles du dioxygène et du dihydrogène égales à P0 = 1,00 bar.
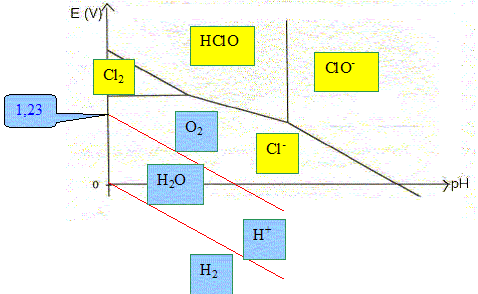
L’élément chlore est utilisé pour désinfecter l’eau des piscines. Une des méthodes actuelles pour réaliser cette opération est de procéder à l’électrolyse d’une solution aqueuse de chlorure de sodium. Les électrodes sont en titane ; les compartiments anodique et cathodique ne sont pas séparés. Écrire les équations des réactions électrochimiques qui peuvent se produire à chacune des électrodes lors de l’électrolyse, en précisant le nom des électrodes. A l'anode positive, oxydation de l'eau et /ou de l'ion chlorure : 2H2O = O2 +4e- + 4H+ ; 2 Cl-(aq)) =Cl2(aq) + 2e-. A la cathode négative réduction de l'eau : 2H2O +2e- = H2 + 2OH- ; En réalité, on observe un dégagement de dichlore gazeux sur l’une des électrodes et de dihydrogène sur l’autre. Proposer une explication. L'oxydation de l'eau en dioxygène doit être plus lente que celle de l'ion en chlorure en dichlore. Il faut également prendre en compte les phénomènes de surtension. Une réaction va se produire en solution aqueuse entre certains des produits de l’électrolyse. Nommer cette réaction et écrire son équation sachant que le pH des eaux de piscine doit être compris entre 7,0 et 7,4. dismutation du dichlore en en ion ClO- et en ion chlorure. Cl2(aq) + 2OH- = ClO-(aq) + Cl-(aq) +H2O. Quelle est l’espèce chlorée responsable de la désinfection de l’eau de la piscine ? ClO-(aq). Une piscine a pour volume 63 m3. La concentration massique initiale en chlorure de sodium Na Cl est c0 = 3,1 g.L-1. L’intensité moyenne du courant qui traverse l’électrolyseur est égale à I = 11 A. Calculer, après une année de fonctionnement à raison de 8 heures par jour, la quantité d’ions chlorure consommée par électrolyse. Quantité d'électricité (C) = intensité (A) * durée (seconde) Q= I t = 11*3600*8*365 =1,156 108 C. Quantité de matière d'électrons correspondante : n( e-) = Q/ 96500 = 1,156 108 /96500 =1,20 103 mol. 2 Cl-(aq)) =Cl2(aq) + 2e-. n(Cl-) = n( e-) =1,20 103 mol masse d'ion chlorure consommés par électrolyse : 1,2 103*35,5 =4,26 104 g = 42,6 kg. Si on ne tenait compte que de la consommation des ions chlorure par l’électrolyse, quelle serait la nouvelle concentration massique en chlorure de sodium de l’eau au bout d’un an ? Masse initiale d'ion chlorure : 3,1*35,5/58,5 = 1,88 g/L ; et dans 63 m3 : 63*3,1*35,5/58,5 = 118,5 kg. Masse restante : 118,5-42,6 = 75,9 kg. soit 75,9 / 63 = 1,2 g/L. Sur le boîtier de la cellule d’électrolyse, on peut lire la recommandation suivante : « Ne pas ouvrir en fonctionnement. Risque d’explosion. ». Justifier cette recommandation. L'électrolyse donne du dihydrogène, insoluble dans l'eau. Ce dernier, en présence du dioxygène de l'air constitue un mélange explosif.
|
|||||||
|
|
|||||||
|
|