|
Concours manipulateur électroradiologie médicale Toulouse 2008 datation au carbone 14 ; acide salicylique En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Etude du carbone 14. Dans la nature le carbone 14 existe sous forme de deux noyaux isotopes stables 126C ( majoritaire) et 136C ( minoritaire) et d'un isotope instable 146C ( très minoritaire). Le temps de demi vie du carbone 14 est 5570 ans. Dans la haute atmosphère un neutron formé par l'action des rayons cosmiques bombarde un noyau d'azote 14 ( Z=7) qui se transforme en carbone 14 radioactif b- avec émission d'une autre particule. Etude du noyau. Le symbole d'un noyau se note AZX. Donner le nom des grandeurs représentées par les lettres A, Z ainsi que leur signification. A : nombre de masse ou nombre de nucléons du noyau. Z : numéro atomique ou nombre de charges ou nombre de protons du noyau. Donner la composition du noyau de carbone 14. Le noyau de carbone 14 compte Z=6 protons et A= 14 nucléons : soit A-Z= 8 neutrons. Définir les termes isotope et "radioactif". Deux noyaux isotopes ne différent que par leur nombre de neutrons. Ils ont le même numéro atomique Z. Le noyau du carbone 14 est radioactif : il se transforme spontanément au cours du temps en émettant une particule et un rayonnement. Les réactions nucléaires. Le bombardement des noyaux d'azote par les neutrons aboutit à la réaction nucléaire (1) : 147N + 10n = AZY1 + 11H Déterminer A et Z et préciser les lois de conservation utilisées. Identifier Y1. conservation du nombre de nucléons : 14+1 = 1 +A d'où A= 14 conservation de la charge : 7+0 = 1 + Z doù Z= 6 ( élément carbone) 147N + 10n = 146C + 11H. La désintégration du carbone 14 conduit à l'émission d'un électron de symbole 0-1e et d'un noyau AZY2 Ecrire l'équation de désintégration du carbone 14. Identifier Y2. 146C = 147N + 0-1e La radioactivité d'une réaction nucléaire peut être du type a, b+, b-. Quelle est celle qui correspond à la désintégration du carbone14. émission d'un électron : donc type b-. La loi de décroissance radioactive . Définir le terme " temps de demi-vie" noté t½. durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. Durée au bout de laquelle l'activité initiale est divisée par 2. La loi de décroissance radioactive en fonction du
temps est du type : N(t) = N0 exp(-lt) N(t) : nombre de noyaux présents à la date t ; N0 : nombre de noyaux initiaux à a date t=0 ; l constante radioactive. N(t½) =½ N0=
N0 exp(-lt½) 0,5 =exp(-lt½)
; ln 0,5 = -lt½
; ln 2 = lt½. ln 2 est un nombre sans dimension, la constante
radioactive est donc l'inverse d'un temps.
t½2 s'exprime en année,
l s'exprimera en
année-1. l = ln 2 / 5570
=1,244 10-4
an-1. ou encore 1,244 10-4 / (365*24*3600)
=3,94 10-12 s-1.
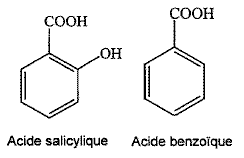 L'acide salycilique (M=138 g/mol) est utilisé dans la synthèse de l'aspirine ; l'acide benzoïque est un conservateur alimentaire. On se propose à partir de mesures conductimétriques de comparer les acidités de l'acide salicylique et de l'acide benzoïque. Etude théorique : Donner la formule brute des deux acides. C7 H6O2 et C7 H6O3. On représentera par la suite , les deux acides par la formule simplifiée HA couple ( AH /A-). On dispose d'un volume V d'une solution aqueuse d'un acide HA de concentration c. La transformation mettant en jeu la réaction de l'acide HA avec l'eau n'est pas totale. Ecrire l'équation de la réaction de HA avec l'eau. HAaq + H2O(l) = A-
aq + H3O+ aq
Exprimer les concentrations des espèces présentes à l'équilibre en fonction de c et de la concentration en ion oxonium [H3O+]éq. [HA]éq=(c V-xéq) / V ; [A- ]éq=[H3O+]éq=xéq /V; [HA]éq= c -[H3O+]éq ; En déduire l'expression du quotient de réaction Qr,éq en fonction de [H3O+]éq. et c. Qr,éq= [A- ]éq*[H3O+]éq / [HA]éq= [H3O+]2éq / (c -[H3O+]éq ). L'étude de la solution à l'équilibre est effectuée par conductimétrie. Exprimer la conductivité s de la solution HA à l'équilibre en fonction de [H3O+]éq et des conductivités molaires ioniques l des ions présents. s = l1[H3O+]éq + l2 [A- ]éq = (l1 + l2 )[H3O+]éq.
Etude exprérimentale : conductivités molaires ioniques à 25°C en S m² mol-1. l1= l ( ion oxonium) = 35 10-3 ; l2= l (ion salicylate)= 3,62 10-3. pKa (acide salicylique / ion salicylate) = 3 ; pKa( acide benzoïque/ ion benzoate) = 4,2. - On dispose du matériel suivant : bechers de 50, 10 et 250 mL ; éprouvettes graduées de 10, 20, 50 et 100 mL ; fioles jaugées de 50, 100 et 250 mL; pipettes graduées de 10 mL à + ou - 0,1 mL; pipette jaugée de 10 mL à + ou - 0,05 mL; pipeteur. On veut préparer une solution S de l'acide HA de concentration c= 10-3 mol/L à partir d'une solution mère S0 de concentration 10-2 mol/L. Comment procède t-on ? Nommer la verrerie utilisée. facteur de dilution = [solution mère] / [solution fille]= 10 le volume de la pipette doit être 10 fois plus petit que le volume de la fiole jaugée. prélever 10 mL de la solution mère à l'aide de la pipette jaugée de 10 mL placer dans une fiole jaugée de 100 mL compléter jusqu'au trait de jauge à l'aide d'eau distillée. Mesures de conductivité : On a effectué un ensemble de mesures de conductivité s pour des solutions d'acide salicylique et d'acide benzoïque de diverses concentrations à 25°C.
[H3O+]éq = 1,86 10-3 mol/L Qr,éq=
[H3O+]2éq
/ (c
-[H3O+]éq
) =(1,86
10-3)2 / (5 10-3
-1,86 10-3) = 3,46
10-3 / 3,14 = 1,1 10-3. à concentration égale l'acide salicylique est plus ionisé que l'acide benzoïque. le taux d'avancement final pour l'acide salicylique est supérieur à celui de l'acide benzoïque. l'acide salicylique, à concentration égale
est plus fort que l'acide benzoïque. La constante d'acidité Ka est la constante de l'équilibre suivant : HA + H2O = A- + H3O+ Ka =[H3O+]éq[A- ]éq /[HA]éq = Qr,éq ; on trouve ( 3 premières lignes du tableau) pKa voisin de 3 pour l'acide salicylique. de même à partir des 3 dernières lignes on retouve le pKa de l'acide benzoïque, voisin de 4,2.
Dosage d'une solution d'acide salicylique ( noté AH). On réalise le titrage pHmétrique d'un volume V1= 10,0 mL de solution saturée d'acide salicylique de concentration c1 par une solution d'hydroxyde de sodium de concentration c2 =0,010 mol/L. On note V2 = 13,5 mL le volume de solution d'hydroxyde de sodium ajouté à l'équivalence. Ecrire l'équation chimique de la réaction de titrage. AH + HO- = A- + H2O. Définir l'équivalence. Quelle est la nature du pH à l'équivalence ? A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. A l'équivalence, la réaction prépondérante, très limitée, est : A- + H2O = AH + HO-. Celle-ci libère des ions hydroxyde en solution : le pH sera donc basique. Exprimer en fonction des données c1 et la concentration massique sA ( g/L) de la solution d'acide salicylique utilisée. c1 V1 = c2 V2 soit c1 = c2 V2 / V1 =0,010*13,5 / 10 = 1,35 10-2 mol/L. sA= c1*M= 0,0135*138 =1,86 g/L. Qu'est ce qu'un indicateur coloré ? Un indicateur coloré contient un couple acide base tel que la teinte de la forme acide soit différente de la teinte de la forme basique. Parmi ceux qui sont proposés quel est celui qui convient le mieux pour réaliser le dosage précédent ? Justifier.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|