|
Autour d'un texte de Brahic : lumières d'étoiles ( bac S Afrique 2009) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
La lumière blanche mélange toutes les couleurs de l'arc en ciel. Comme on passe continûment d'une couleur à une autre en changeant graduellement de nuance, on dit que la lumière blanche possède un spectre continu. C'est le cas de la lumière émise par un corps chaud qui contient toutes les couleurs à des doses différentes. Plus la température est forte, plus la couleur dominante se déplace du micro-onde vers les X. Mais les astronomes ont remarqué dès le XVIIIe siècle la présence de fines bandes noires dans la lumière solaire. Il manque des couleurs très précises et spécifiques, comme si elles ne nous étaient pas parvenues. Après quelques tâtonnements, ils ont compris que ces raies sombres trahissaient la présence d'éléments chimiques sur le trajet des rayons lumineux. Joseph von Fraunhofer fut le premier en 1814 à observer ces disparitions de lumière et à les attribuer à un phénomène d'absorption par un gaz situé entre la source d'émission et l'observateur... Pour résoudre ce problème, il faut faire appel à la nature ondulatoire de l'électron et ranger l'onde de chaque électron autour du noyau comme des livres sur une étagères d'une bibliothèque. Chaque étage correspond à une énergie spécifique pour laquelle l'électron est stable. Un livre ne peut pas être entre deux étagères, sinon il tombe de même les électrons peuvent avoir des énergies bien définies, mais ils ne peuvent pas se trouver dans un état intermédiaire. Pour passer d'un niveau à un autre plus élevé, un électron absorbe un photon lumineux qui lui apporte l'énergie supplémentaire dont il a besoin pour "grimper" sur une autre étagère. Inversement quand il "redescend" il rend cette énergie sous forme d'un photon. Dans cette bibliothèque particulièrement riche, chaque atome est unique et caractéristique. On peut donc à distance reconnaître la présence d'un atome aux couleurs des photons qu'il émet ou absorbe lorsque ses électrons changent d'"étagère". On donne : c = 2,997 108 m/s ; h = 6,62 10-34 J s ; 1 eV = 1,6 10-19 J. Donner les valeurs limites des longueurs d'onde dans le vide du spectre visible en précisant les couleurs concernées. Limite entre l'ultraviolet et le violet : 400 nm Limite entre l'infrarouge et le rouge : 780 nm. Quelle est la relation entre la longueur d'onde dans le vide d'une radiation et sa fréquence ? Préciser les unités. l = c / n ; longueur d'onde en mètre; célérité en m s-1 et fréquence en Hertz. fmicro-ondes = 3,0 1014 Hz
; fX = 3,0 1018 Hz. Calculer l'ordre de
grandeur des longueurs d'onde correspondantes dans
le vide. lmicro-ondes
= c / n
micro-ondes = 2,997
108 / 3,0 1014 ~
1 x 10-6
m. lX=
c / n
X = 2,997 108 /
3,0 1018 ~ 1 x
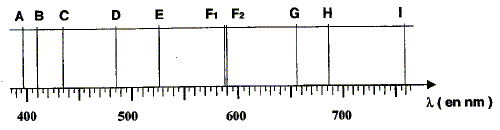
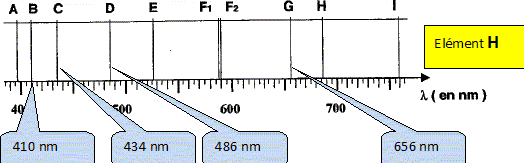
10-10 m. E = h n ; l'énergie d'une radiation est dautant plus grande que sa fréquence est grande. Les rayons X ayant une plus grande fréquence que les micro-ondes sont plus énergétiques que les micro-ondes. "Joseph von Fraunhofer fut le premier en 1814 à observer ces disparitions de lumière" Voici une partie du spectre qu'il a observé, où l'on peut observer des raies noires sur un fond coloré continu, nommées A, B, C, D, E, F1, F2, G, H et I.
Les raies observées ci-dessus sont-elles des raies d'émission ou d'absorption ? Des raies noires sur un fond coloré continu correspondent à un spectre de raies d'absorption.
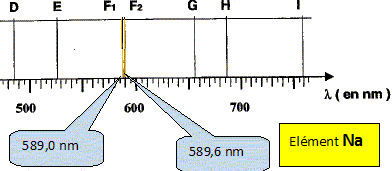
On donne les longueurs d'onde d'émission de quelques éléments.
" Chaque étage correspond à une énergie spécifique pour laquelle l'électron est stable. Un livre ne peut pas être entre deux étagères, sinon il tombe de même les électrons peuvent avoir des énergies bien définies, mais ils ne peuvent pas se trouver dans un état intermédiaire. " Quelle propriété de l'énergie d'un atome est évoquée dans cette partie du texte ? L'énergie d'un atome est quantifiée, seules un petit nombre de valeurs sont possibles.
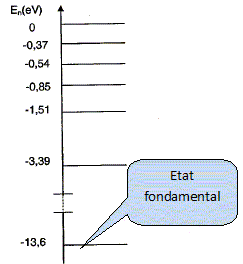
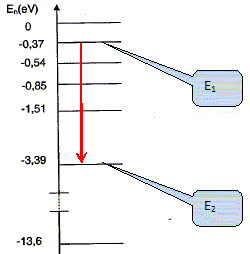
On donne le diagramme de niveaux d'énergie de l'hydrogène. On rappelle que l'état fondamental d'un atome correspond à l'état dans lequel il possède le moins d'énergie. Quel est le niveau d'énergie de l'état fondamental de l'atome d'hydrogène ?
Calculer la variation d'énergie lorsque l'atome passe de E1 = -0,37 eV à E2 = -3,39 eV. E2-E1 = -3,39 - (-0,37) = - 3,02 eV. L'atome cède de l'énergie au milieu extérieur, d'où le signe moins. Convertir en Joule la variation d'énergie précédente. -3,02 * 1,6 10-19 = -4,83 10-19 ~ -4,8 10-19 J.
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||