|
Le cycle de l'eau ; les eaux potables physique bac L Asie 09 |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
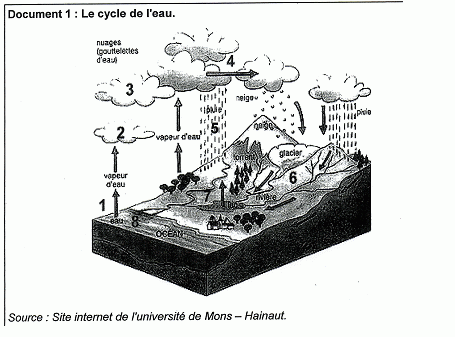 Document 2 : L'eau ? un produit naturel méconnu. Schématiquement, l'eau évolue entre trois secteurs : les océans ( hydrosphère), l'atmosphère et les sols ( lithosphère). La terre recevant l'énergie solaire, l'hydrosphère s'évapore, conduisant à la présence d'eau dans l'atmosphère. Cette eau, suite à un refroidissement de l'air, se condense en gouttes ou en cristaux de glace et se retrouve précipitée sous forme de pluie, neige ou grêle sur la lithosphère à la surface de laquelle approximativement 1 / 4 pénètre, 1 / 4 ruisselle. La moitié restante, s'évapore à son tour. Les eaux superficielles sont constituées par les eaux des ruisseaux, rivières, fleuves, étangs, lacs, barrages-réservoirs et glaciers.... Les fleuves et les rivières, outre les eaux de pluie, sont alimentés par les nappes souterraines, surtout mises à contribution en été quand les pluies sont beaucoup plus faibles. On estime à environ 3 milliards de m3 / an la quantité d'eaux souterraines qui participent, dans le bassin de la Seine, à l'alimentation des fleuves et des rivières. Les débits des fleuves et des rivières vont donc varier entre deux extrèmes : étiages et crues. En période de sécheresse annuelle, leur débit est minimum et quasiment exclusivement fourni par les eaux souterraines ( période d'étiage). Site internet cultureSciences-chimie. Article écrit par C.Cun ( centre de recherche et de contrôle des eaux de Paris ). Comment évolue, dans le temps, la quantité totale d'eau sur terre ? La quantité d'eau est constante : l'eau décrit un cycle fermé " l'hydrosphère s'évapore, conduisant à la présence d'eau dans l'atmosphère. Cette eau, suite à un refroidissement de l'air, se condense en gouttes ou en cristaux de glace et se retrouve précipitée sous forme de pluie, neige ou grêle sur la lithosphère "
Les océans,
l'atmosphère et la lithosphère ( les sols).
Par la mesure de
quel paramètre peut-on reconnaître le caractère acide, basique ou
neutre d'une solution ?
Dosages des ions chlorure. - En versant progressivement des ions argent (Ag+) dans une solution contenant des ions chlorure ( Cl-), il se forme un précipité blanc de chlorure d'argent. - Les ions argent produisent avec le chromate de potassium un précipité rouge. On souhaite doser les ions chlorure présents dans une eau du robinet. Pour cela : (1) on verse tout d'abord, à l'aide d'une burette graduée, une solution de nitrate d'argent dans 10 mL d'une solution de chlorure de potassium de concentration massique connue ( C1) contenant quelques gouttes de chromate de potassium. (2) On effectue ensuite la même manipulation en remplaçant la solution de chlorure de potassium par 10 mL d'eau du robinet. On note V2 le volume de solution de nitrate d'argent versé à l'apparition du précipité rouge. 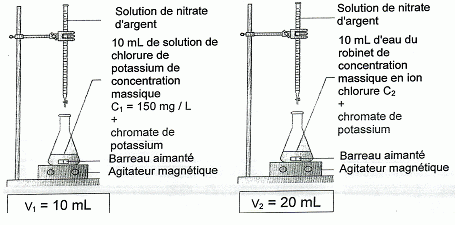 . La burette graduée. Dans cet exemple de dosage, le volume de
solution de nitrate d'argent versé est proportionnel à la concentration
en ion chlorure. d'où : C2 = V2 / k = V2 C1/ V1 =20 *150 /10 = 300 mg/L. Plus simplement, on remarque que V2 = 2 V1, donc C2 = 2 C1 = 2*150 = 300 mg/L. L'eau
du robinet satisfait-elle aux critères de potabilité ?
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
|