|
Suivi spectrophotométrique ( bac S Reunion 2009) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2MnO4- aq +5 H2C2O4 aq + 6 H+ aq = 2 Mn2+ aq + 10 CO2 aq + 8 H2O (l) (1). La transformation sera considérée comme totale. Seul l'ion permanganate est coloré. On mélange un volume V1 = 1,00 mL de solution aqueuse de permanganate de potassium de concentration molaire en soluté apporté c1 = 9,50 10-4 mol/L, acidifié en excès par de l'acide sulfurique, à un volume V2 = 1,00 mL d'une solution aqueuse d'acide oxalique de concentration molaire en soluté apporté c2 = 2,50 10-2 mol/L. On désigne par V = V1+V2 le volume total du mélange réactionnel. Ce volume reste constant et il en est de même de la température. Réaction d'oxydoréduction. L'ion permanganate intervient par le couple MnO4- aq / Mn2+ aq. MnO4-
aq + 8 H+ aq
+ 5e- = Mn2+
aq + 4 H2O(l). Quel est l'oxydant de
ce couple.
Justifier. L'oxydant, l'ion
MnO4- aq gagne des
électrons lors d'une
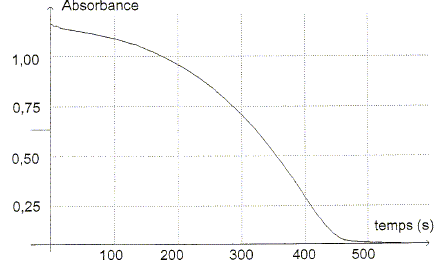
réduction. Ecrire la demi-équation électronique de ce couple. H2C2O4 aq = 2 Mn2+ aq + 2 CO2 aq +2 H+ aq + 2e-. La transformation chimique étant lente, on peut suivre son évolution à l'aide d'un spectrophotomètre relié à un ordinateur, en mesurant l'absorbance A du mélange réactionnel en fonction du temps.
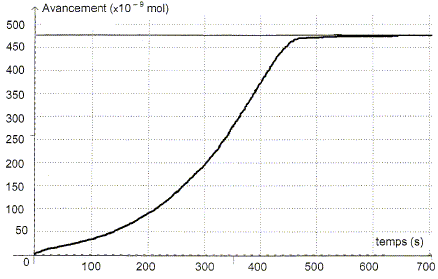
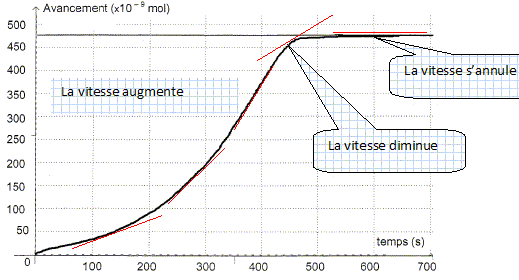
Etude de la réaction. A partir de l'absorbance de la réaction, il est possible d'en déduire l'avancement x de la réaction en fonction du temps.
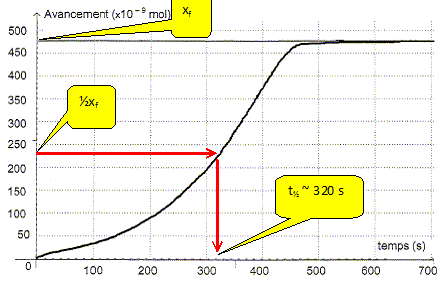
L'absorbance du mélange réactionnel à l'état final est nulle. Identifier sans calcul le réactif limitant. Justifier. La seule espèce colorée, l'ion permanganate disparaît du milieu réactionnel à l'état final : MnO4- aq constitue le réactif limitant. Déterminer la valeur de l'avancement final xf. D'après le tableau ci-dessus xf = 475 10-9 = 4,75 10-7 mol. Exprimer la quantité de matière en ion Mn2+ aq dans l'état final en fonction de xf et calculer sa valeur.
En déduire la concentration molaire en ion Mn2+ aq lors de cette transformation chimique. [Mn2+ aq] = n(Mn2+ aq) / V = 9,50 10-7 / 2,00 10-3 =4,75 10-4 mol/L. Définir le temps de demi-réaction t½ et déterminer graphiquement sa valeur. Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|