|
Pile, électrolyse, ester concours Fesic 2009
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||
| .
. |
|||||||||||||||
| .
. |
|||||||||||||||
|
A- L'eau est l'oxydant du couple redox auquel appartient l'hydrogène. Vrai. Un oxydant est une espèce qui gagne des électrons ; l'eau gagne deux électrons, c'est l'oxydant du couple H2O(l) / H2(g). B- Le dihydrogène apparaît à la cathode de l'électrolyseur. Vrai. L'eau, l'oxydant se réduit : une réduction se produit à la cathode. C-La quantité de matière de dihydrogène produite est 9 kmol par heure. Faux. n(H2) = 450 103 / 25 mol = 450 / 25 kmol = 18 kmol par heure. D- La charge ayant circulée dans l'électrolyseur en une heure est environ 3,6 109 C. Faux. Intensité = puissance / tension ; I = 2,2 106/1,8 A Charge Q = I t = 2,2 106/1,8 *3600 = 2,2 109 *1,8/3,6 = 4,4 109 C. (environ 3,6 109 C à 20% près ) On électrolyse pendant une durée Dt = 10 min, une solution aqueuse de nitrate de plomb(II) ( Pb2+aq + 2NO3-aq) entre deux électrodes de plomb. B-
L'électrode
reliée à la borne positive du
générateur est
l'anode.
Vrai. réduction à la cathode négative : Pb2+aq +2e- = Pb(s), la masse de la cathode augmente. La variation de masse est |Dm|= 20,8 g durant les 10 min d'électrolyse. M(Pb) = 208 g/mol. 1 F = 1,0 105 C/mol. D- L'intensité du courant est environ 16,7 A. Faux. n(Pb) = m/M = 20,8/208 = 0,1 mol ; n(e-) = 2n(Pb) = 0,2 mol Charge Q =n(e-) F = 0,2 105 = 2 104 C I = Q/Dt
= 2 104 /(10*60) =200/6 ~33
A.
Zn(s) / Zn(OH)42-aq // Ag2O(s) /Ag(s) l'électrolyte est une solution concentrée de potasse ( K+aq + HO-aq ). L'équation chimique modélisant la transformétion chimique de fonctionnement de la pile est : Zn(s) + 2HO-aq + Ag2O(s) +H2O(l)= Zn(OH)42-aq +2Ag(s). 1 F = 1,0 105 C/mol ; 1,8*6,5~12. A- Ce type de pile est dite saline. Faux. alcaline B- Le pôle positif est l'électrode de zinc. Faux. Le zinc s'oxyde et libère des électrons : Zn(s) + 4HO-aq =Zn(OH)42-aq +2e-. Le zinc constitue l'anode négative de la pile. La masse de l'électrode de zinc est égale à 0,12 g. Le zinc est le réactif limitant.M(Zn) = 65 g/mol C-La capacité de cette pile est égale à 100 mA h. Vrai. n(Zn) = 0,12/65 mol ; n(e-) = 2n(Zn) = 2*0,12/65 = 2*12 10-2/65 = 2 *10-3*12/6,5 =2*1,8 10-3 = 3,6 10-3 mol Charge Q = n(e-) F = 3,6 10-3 * 1,0 105 = 360 C Q = I t = 360 C = 360/3600 Ah = 0,1 Ah = 100 mA h. D- La pile en fonctionnement est un système à l'équilibre. Faux. Lorsque l'équilibre est atteint (Qr = K ), la pile est usée.
L'huile de colza est constituée essentiellement de trilinoléate de glycéryle de formule : 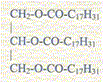
Le trilinoléate s'hydrolyse lentement au cours du temps, en libérant de l'acide linoléïque, ce qui rend l'huile inconsommable. Afin de vérifier la teneur massique en acide, on réalise le dosage acide-base suivant : dans un erlenmeyer on mélange 10 g d'huile de colza, 10 mL d'éthanol et quelques gouttes d'indicateur coloré ; puis on réalise , à 25°C, le titrage de l'acide linoléïque contenu dans le mélange par une solution aqueuse d'hydroxyde de sodium de concentration molaire c = 5,0 10-2 mol/L. Le virage est obtenu pour un volume équivalent VE = 4,0 mL. Masse molaire de l'acide linoléïque M = 280 g/mol ; pKa ( acide linoléïque) = 7,6.
A- L'hydrolyse de l'huile libère du glycérol. Vrai. L'hydrolyse d'un triester du glycérol libère un trialcool, le glycérol. B- l'éthanol est un réactif de la réaction de titrage. Faux. Les réactifs sont l'acide linoléïque et la potasse. Pour être consommable cette huile ne doit pas contenir plus de 1% d'acide. C- L'huile est consommable. Vrai. Quantité de matière de potasse à l'équivalence : c VE = 5,0 10-2 * 4,0 10-3 = 2,0 10-4 mol. Quantité de matière d'acide linoléïque : n=2,0 10-4 mol. Masse d'acide : m = n M = 2,0 10-4 *280 = 5,6 10-2 g d'acide dans 10 g d'huile soit : 5,6 10-2 *100/10 =0,56 %. D- Parmi les indicateurs colorés cités, la phénolphtaléïne est adaptée . Vrai. A l'équivalence, on a une solution de linoléate de potassium ; l'ion linoléate est majoritaire ; pHE > pKa ; pHE > 7,6. de plus, la zone de virage de l'indicateur coloré doit contenir le pH du point équivalent.
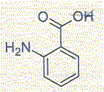
La fleur d'oranger peut être obtenue à partir d'acide anthranilique et de méthanol. On réalise un montage à reflux avec un mélange stoechiométrique des deux réactifs en présence d'acide sulfurique et de quelques grains de pierre ponce. Grâce à un dispositif approprié on élimine l'eau au fur et à mesure de sa formation. M( acide anthranilique) = 137 g/mol; M( méthanol) = 32 g/mol ; masse volumique du méthanol : 0,80 g/mL. Formule topologique de l'acide
anthranilique :
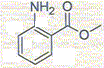
M(éthanol) = 46 gmol ; M(F)=102 g/mol ; masse
volumique éthanol = 0,80 g/mL.
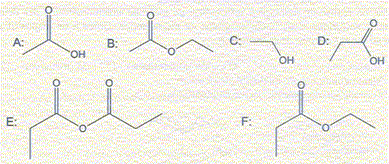
A- Le nom de la molécule B est méthanoate d'éthyle. Faux. ( éthanoate d'éthyle). Il existe deux méthodes pour préparer le composé F à partir des réactifs présents dans la liste. Dans ces deux méthodes les proportions des réactifs sont équimolaires et la température est la même. La première méthode conduit à un rendement de 60% ; il faut attendre plusieurs jours pour que l'avancement n'évolue plus. La seconde méthode conduit à un rendement de 90% au bout de quelques heures. Dans la méthode 1. B- La transformation chimique fait intervenir les réactifs C et D. Vrai. C- A partir de 300 mL d'alcool, il se forme environ 4 g de produit F. Faux. masse éthanol : m = 300*0,80 = 240 g n(éthanol) = 240/46 = 5,2 mol n(F) = 5,2 * 0,6 = 3,1 mol ; m(F) = n m = 3,1*102 = 3,2 102 g. Dans la méthode 2. D- La transformation chimique ayant lieu se traduit par l'équation de réaction E+C = F+D. Vrai.
|
|||||||||||||||
|
|
|||||||||||||||
|
|
 .
Vrai.
.
Vrai.